Técnicas de obtención y cultivo de larvas L3 de nematodos gastrointestinales de rumiantes
DOI:
https://doi.org/10.29059/cvpa.v2i1.20Palabras clave:
Desarrollo larval, helmintos, parasitosisResumen
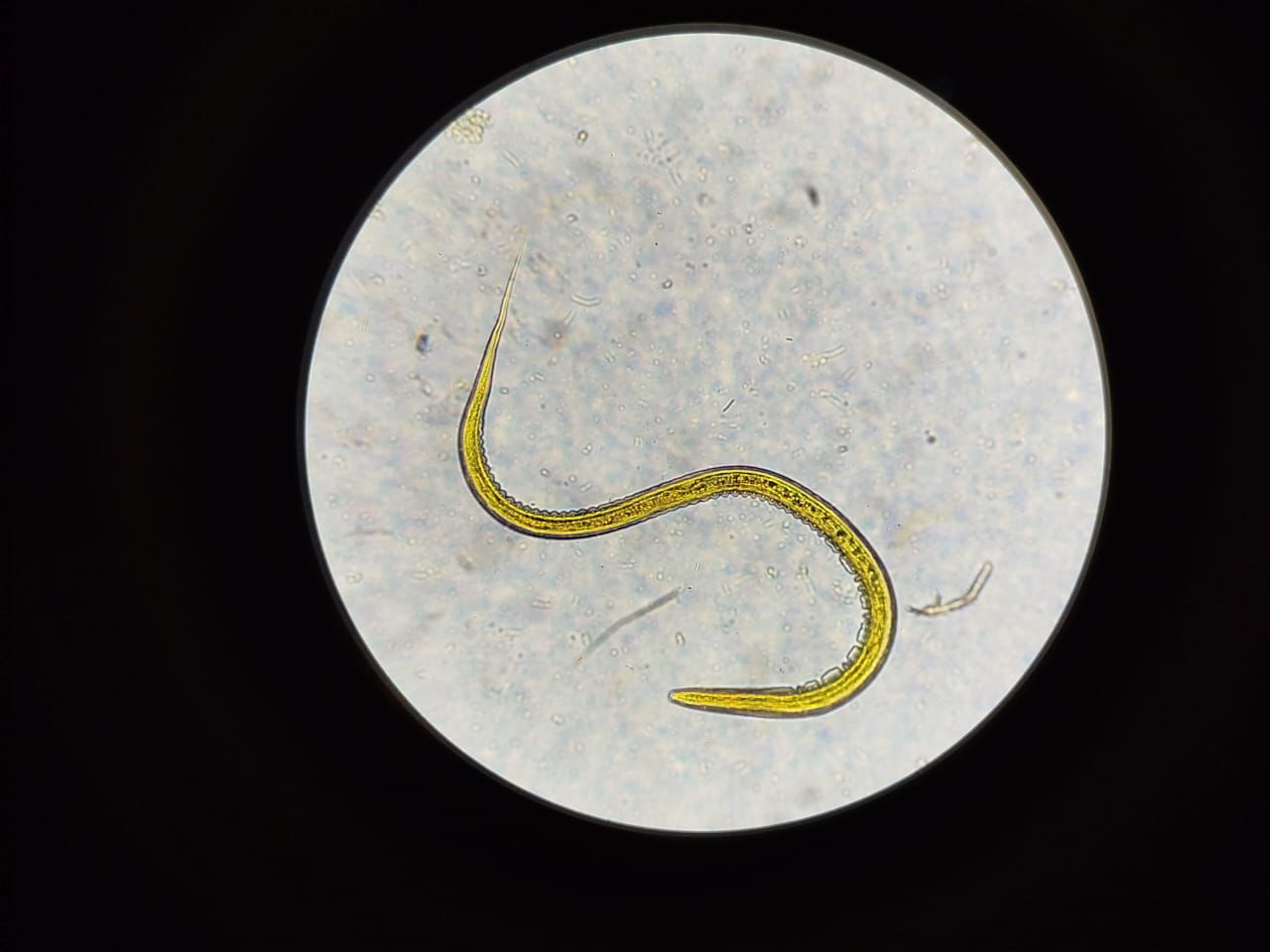
Los nematodos gastrointestinales de rumiantes presentan un ciclo de reproducción similar, en su tercer estadio, afectan al huésped. Los coprocultivos permiten obtener los diferentes estadios. El objetivo de esta revisión fue brindar un panorama general de las técnicas de coprocultivo para la obtención de larvas L3 de los nematodos gastrointestinales de rumiantes. La búsqueda de información se realizó con buscadores académicos vinculados a recursos originales y verídicos: Web of Science, Google Académico, Scopus, Dialnet, SciELO y PubMED. Se seleccionaron aquellas publicaciones que abordaron técnicas de cultivos de nematodos gastrointestinales de rumiantes: bovinos, caprinos y ovinos. En el proceso de obtención de larvas se deben tomar en cuenta factores como la carga parasitaria, traslado de muestras al laboratorio, monitoreo de la humedad, temperatura y un material inerte que permita la oxigenación de las muestras. El mantenimiento de la fase infectante requiere aislar y proporcionar un medio alimenticio para garantizar su supervivencia.
Citas
Afreen, F. J., Palanivelrajan, M., Gomathinayagam, S. & Jayathangaraj, M. G. (2019). Copro-culture study of nematode larvae in Black Bucks (Antilope cervicapra). The Indian Veterinary Journal, 96(1), 38-40.
Aguilar-Caballero, A., Torres-Acosta, F. & Cámara-Sarmiento, R. (2009). Importancia del parasitismo gastrointestinal en ovinos y situación actual de la resistencia antihelmíntica en México. Avances en el control de la parasitosis gastrointestinal de ovinos en el trópico. Universidad Autónoma Chapingo, México.
Aguilar-Caballero, A., Torres-Acosta, F., Cámara-Sarmiento, R. & Sandoval-Castro, C. A. (2011). El control de los nematodos gastrointestinales en caprinos: ¿dónde estámos? Bioagrociencias, 4(2), 1-16.
Alaro, T., Dulo, F., Wodajo, W. & Mathewos, L. (2023). Anthelmintic resistance of gastrointestinal nematodes of communally-grazing goats in Humbo District, Southern Ethiopia, Veterinary Medicine. Research and Reports, 14, 185-194. https://doi.org/10.2147/VMRR.S434584. DOI: https://doi.org/10.2147/VMRR.S434584
Alcalá, C. Y., Álvarez, M. J. A., Cruz. V. C., Escutia, S. I., Figueroa, M. J., Liébano, H. E., López, A. M., Neri, O. S., Ramírez, V. G., Rojas, M. C. & Vega, M. C. (2019). Técnicas para el diagnóstico de parásitos con importancia en salud pública y veterinaria. Cultivo y mantenimiento de parásitos vivos. Editor. AMPAVE-CONASA. México, D.F.
Álvarez, C. V., Hernández, J. & Wing, C. R. (2007). Eficacia de aserrines para inhibir el desarrollo in vitro de larvas de parásitos gastrointestinales de ovinos. Agronomía Costarricense, 31(1), 71-75. https://www.redalyc.org/pdf/436/43631108.pdf. DOI: https://doi.org/10.15517/rac.v31i1.6821
Arcila, G. J. L. & Benavides, M. J. A. (2002). Toma de muestras y técnicas de diagnóstico parasitológico en materia fecal. ICA Informa, 1, 51-54. http://hdl.handle.net/20.500.12324/18172.
Balic, A., Bowles, V. M. & Meeusen, E. N. (2000). The immunobiology of gastrointestinal nemato de infections in ruminants. Advance in Parasitology, 45(181-241) https://doi.org/10.1016/S0065-308X(00)45005-0. DOI: https://doi.org/10.1016/S0065-308X(00)45005-0
Benavides, O. E. (2012). Enseñanza de la parasitología veterinaria a partir del uso de organismos vivos y tecnologías de la información y de la comunicación (TIC). Revista Medicina Veterinaria, 23 (97-10). https://doi.org/10.19052/mv.78. DOI: https://doi.org/10.19052/mv.78
Benavides, O. E. V. (2013). Técnicas para el diagnóstico de endoparásitos de importancia veterinaria. Veterinaria y Zootecnia, 11, Colombia, Universidad de la Salle, 180 p. https://doi.org/10.19052/9789585136366. DOI: https://doi.org/10.19052/9789585136366
Campos-López, N., Zaragoza-Vera, C. V., Arjona-Jiménez, G., Zaragoza-Vera, M., González-Garduño, R., Chan-Escalante, R. A., Cámara-Sarmiento, R. & Aguilar-Caballero, A. J. (2017). Efecto del tamaño de camada sobre la carga parasitaria gastrointestinal durante la lactancia en ovejas Pelibuey. Avances de la investigación sobre producción de ovinos de pelo en México (1ª ed). Universidad Juárez Autónoma de Tabasco, Instituto Tecnológico de la Zona Maya e Instituto Tecnológico de Chiná. 232 p.
Cerutti, J. (2017). Técnica de inmunofluorescencia para identificación de huevos del género Haemonchus en ovinos. Universidad Nacional de la Plata. https://sedici.unlp.edu.ar/handle/10915/111934.
Chuchuca, C. A. M. (2019). Prevalencia de parasitosis intestinal en el ganado bovino mediante el análisis coprológico cuantitativo. Universidad Politécnica Salesiana. http://dspace.ups.edu.ec/handle/123456789/17638.
Córdova, G. N. L., León, L. E. Q., Almeyda, M. E. D., Sánchez, E. V. & Bravo, G. A. C. (2021). Gastrointestinal parasites in cattle in from peasant communities of Santa Cruz, Cajamarca-Perú. Brazilian Journal of Development, 7(8), 77250-63. https://doi.org/10.34117/bjdv7n8-102. DOI: https://doi.org/10.34117/bjdv7n8-102
Dey, A. R., Begum, N., Anisuzzaman, Alim, M. A. & Alam, M. Z. (2020). Multiple anthelmintic resistance in gastrointestinal nematodes of small ruminants in Bangladesh. Parasitology International, 77, 102105. https://doi.org/10.1016/j.parint.2020.102105. DOI: https://doi.org/10.1016/j.parint.2020.102105
Dias, L. F., Lopes, A. R. C., Costa, S. L. P., Magri, F. C., Ribeiro, B. F. & Victor, J. A. (2018). Coadministration of nematophagous fungi for biological control over nematodes in bovine in the South-Eastern Brazil. BioMed Research International, 1(1-6), 2934674 https://doi.org/10.1155/2018/2934674. DOI: https://doi.org/10.1155/2018/2934674
Ensuncho, H. C., Castellano, C. A., Maza, Á. L., Bustamante, Y. M. & Vergara, G. O. (2014). Prevalencia y grado de infección de nematodos gastrointestinales en ovinos de pelo en pastoreo de cuatro municipios de Córdoba, Colombia. Revista Científica, 8(5). pp. 414-420. https://www.redalyc.org/pdf/959/95932260005.pdf.
Fiel, C. A., Steffan, P. E. & Ferreyra, D. A. (2011). Diagnóstico de las parasitosis más frecuentes de los rumiantes: técnicas de diagnóstico e interpretación de resultados. Universidad Nacional del Centro de la Provincia de Buenos Aires. Argentina. 131 p.
Figueroa-Antonio, A., Pineda-Rodríguez, S.A., Godínez-Jaime, F., Vargas-Álvarez, D. & RodríguezBataz, E. (2018). Parásitos gastrointestinales de ganado bovino y caprino en Quechultenango, Guerrero, México. Agroproductividad, 11(6), 97-104. https://revista-agroproductividad.org/ index.php/agroproductividad/article/view/438/318.
Fox, M. T. (1997). Pathophysiology of infection with gastrointestinal nematodes in domestic ruminants: recent developments. Veterinary parasitology, 72(3-4), 285-308. https://doi.org/10.1016/S0304-4017(97)00102-7. DOI: https://doi.org/10.1016/S0304-4017(97)00102-7
García, A. C. A. (2019). Actividad antihelmíntica in vitro e in vivo de extractos de planta silvestre y raíces pilosas de Waltheria americana Linn. [Tesis de maestría, Universidad Autónoma del Estado de Morelos]. http://riaa.uaem.mx/handle/20.500.12055/1812.
Guerrero, L., Rossini, M., Bethencourt, A., Colmenares, O., Rueda de Arvelo, E., & Ríos de Álvarez, L. (2017). Efecto de la suplementación con semilla de Canavalia ensiformis sobre parásitos gastrointestinales y comportamiento productivo de corderas Wesest African. Revista de la Facultad de Ciencias Veterinarias, 58(1), 24-33.
Hernández Barral, Á. (2011). Estudio de la respuesta inmune frente a Haemonchus contortus en dos razas ovinas canarias. [Tesis doctoral]. http://hdl.handle.net/10553/6295.
Hernández, A. D., Kantner, B., Santos, E., Major, S., Carr, R. & Li, Y. (2023). The number of Oesophagostomum spp. larvae recovered in coprocultures varies with media used. Journal of Helminthology, 97. https://doi.org/10.1017/S0022149X23000391. DOI: https://doi.org/10.1017/S0022149X23000391
Lascano, G. C. P. (2009). Taninos condensados y su efecto sobre los parásitos gastrointestinales de ovinos. Universidad de la Salle, Bogotá. Colombia. https://ciencia.lasalle.edu.co/medicina_veterinaria/322.
Leandro-Picado, A. M., Calderón-Sancho, A. & Alfaro-Mora, R. (2020). Evaluación del tiempo en la recuperación de larvas de nematodos a partir de un coprocultivo. Revista Colombiana de Ciencia Animal - RECIA, 12(1), 744. https://doi.org/10.24188/recia.v12.n1.2020.744. DOI: https://doi.org/10.24188/recia.v12.n1.2020.744
López, M. Y. (2009). Identificación de nematodos gastrointestinales de bovinos cebú a inicios de época lluviosa en la EEAS – UNCP 2008. [Tesis de Licenciatura, Universidad Nacional del Centro de Perú]. http://hdl.handle.net/20.500.12894/1920.
Marie-Magdeleine, C., Hoste, H., Mahieu, M., Varo, H. & Archimede, H. (2009). In vitro effects of Cucurbita moschata seed extracts on Haemonchus contortus. Veterinary Parasitology, 161(1-2), 99-105. https://doi.org/10.1016/j.vetpar.2008.12.008. DOI: https://doi.org/10.1016/j.vetpar.2008.12.008
Maristela, P. E., Spacagna, J. R. & de Campos, N. A. H. (2017). Manual veterinario de toma y envío de muestras: manual técnico. Cooperación técnica MAPA/OPS/PANAFTOSA para el fortalecimiento de los programas de salud animal de Brasil. https://iris.paho.org/handle/10665.2/34527.
Márquez, L. D. (2014). Control sostenible de los nematodos gastrointestinales en rumiantes. Corporación Colombiana de Investigación Agropecuaria-CORPOICA. http://hdl.handle.net/20.500.12324/12620. DOI: https://doi.org/10.21930/978-958-740-191-2
Martínez-Martínez, R., de Jesús Pérez-Bautista, J., Hernández-Mogica, M., Lemus, M. T. G., Hernández, I. D. J. A. & Pedroza, S. I. M. (2021). Identificación y conteo de parásitos gastrointestinales en ovinos Dorper en Atlapexco, Hidalgo, México. Ecosistemas y Recursos Agropecuarios, 8(2). https://doi.org/10.19136/era.a8nII.2873. DOI: https://doi.org/10.19136/era.a8nII.2873
Maurizio, A., Marchiori, E., Tessarin, C. & Cassini, R. (2023). Comparing pooled and individual samples for estimation of gastrointestinal strongyles burden and treatment efficacy in small ruminants. Veterinary Parasitology, 318, 109935. https://doi.org/10.1016/j.vetpar.2023.109935. DOI: https://doi.org/10.1016/j.vetpar.2023.109935
Maza, L. J. (2018). Caracterización bioquímica parcial y funcional de las proteínas de secreción de 70 kDa derivadas de larvas L4 del nematodo Haemonchus placei. [Tesis de Maestría, Universidad Autónoma del Estado de Morelos].
Méndez, S. M. (2019). Análisis hematológicos y parasitológicos en pequeños rumiantes. Universidad Nacional, Costa Rica. http://hdl.handle.net/11056/17663.
Montoya, F. N., Bengoa, V. E. P. & Pinillos, D. M. B. (2005). Evaluación de técnicas para la conservación y cultivo de parásitos gastrointestinales en primates de vida silvestre. Revista de Medicina Veterinaria, 9, 47-57.
Munguía-Xóchihua, J., Reyna-Granados, J., Leyva-Corona, J. & Morales-Pablos, M. (2023). Tolerancia de muestras de heces fecales a diferentes tiempos de refrigeración para la recuperación de larvas infectantes de Haemochus contortus en bioensayos coproparasitológicos con ovinos. Revista Latinoamericana de Recursos Naturales, 19(2), 36-41.
Ojeda-Robertos, N. F., Torres-Acosta, J. F., Mendoza-de Gives, P., Gonzalez-Garduņo, R., Valero-Coss, R. O., Liébano-Hernández, E. & Ayala-Burgos, A. (2015). Optimizing the use of Duddingtonia flagrans chlamydospores against Haemonchus contortus in feces of sheep. Tropical and Subtropical Agroecosystems, 18(3). http://dx.doi.org/10.56369/tsaes.2115. DOI: https://doi.org/10.56369/tsaes.2115
Olazarán, J. S., Arellano, M. E., López, I., De Gives, P. & Juárez, A. (2019). Evaluación de la resistencia antihelmíntica de nematodos gastrointestinales a bencimidazol en ovinos en el estado de Puebla. Investigaciones Científicas y Agrotecnológicas para la Seguridad Alimentaria, 343.
Olivares, S. M. I. (2023). Notas y apuntes: material, toma y envío de muestras biológicas para diagnóstico de laboratorio veterinario. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México.
Orozco, M., Álvarez, V., Jiménez, A. & Acuña, Ó. (2009). Evaluación in vitro de hongos nematófagos para el control biológico de nematodos gastrointestinales de rumiantes. Revista MVZ Córdoba, 14(3), 1820-1830. DOI: https://doi.org/10.21897/rmvz.342
Ortiz, M. C. M., de Jesús, T. A. J. F., Ojeda, R. N. F., González, R. L. & Muñoz, M. S. A. (2022). Manejo integrado de parásitos en pequeños rumiantes. Bioagrociencias, 15(2). DOI: https://doi.org/10.56369/BAC.4463
Pedrozo-Prieto, R., Britos-Moreno, B., Chirife-Cardozo, C. & Sandoval-Candia, C. (2015). Efecto del uso de moxidectina sobre la carga parasitaria y eritrograma de corderos en tres establecimientos ubicados en el distrito de Hernandarias, Paraguay. Compendio de Ciencias Veterinarias, 5(1), 36-42. https://doi.org/10.18004/compend.cienc.vet.2015.05.01.36-42. DOI: https://doi.org/10.18004/compend.cienc.vet.2015.05.01.36-42
Pimentel, B. S. (2020). Puesta a punto y validación de metodologías basadas en ADN para diagnóstico de nematodos gastrointestinales de ovinos, en Uruguay. [Tesis de maestría, Universidad de la República Uruguay]. https://hdl.handle.net/20.500.12008/27248.
Preliasco, F. A. (2017). Estudio in vitro del efecto de Baccharis trimera sobre Haemonchus contortus. [Tesis Doctoral, Universidad de la República de Uruguay]. https://hdl.handle.net/20.500.12008/25025.
Puicón, V., López-Flores, A., Fabian-Dominguez, F. & Sánchez-Cárdenas, H. (2022). Prevalencia coprológica de parásitos intestinales en humanos y porcinos de crianza de traspatio del distrito de Zapatero, San Martín. Revista de Veterinaria y Zootecnia Amazónica, 1(1), 4-14. https://doi.org/10.51252/revza.v1i1.127. DOI: https://doi.org/10.51252/revza.v1i1.127
Rajpoot, J., Shukla, S., Jatav, G. P., Garg, U. K. & Agrawal, V. (2017). Coproculture study of strongyle infection of goats from Malwa region of Madhya Pradesh. Journal of Entomology and Zoology Studies, 5(5), 876-878.
Ramírez, A. M., Saldaña-Pérez, L., Arrellano-Rocha, R. E., Chagoya-Sánchez, M., Chávez, A. J. G. & Angel-Sahagún, C. A. (2022). Prevalencia de parásitos gastrointestinales en pequeños rumiantes. Jóvenes en la Ciencia, 16, 1-3.
Ray, G. H. & Mansfield, L. S. (1995). Characterization of excretory-secretory products from larval stages of Haemonchus contortus cultured in vitro. Veterinary Parasitology, 62, 291-305. https://doi.org/10.1016/0304-4017(95)00871-3. DOI: https://doi.org/10.1016/0304-4017(95)00871-3
Reyes-Guerrero, David., Olmedo-Juárez, A. & Mendoza-de Gives, P. (2021). Control y prevención de nematodosis en pequeños rumiantes: antecedentes, retos y perspectivas en México. Revista Mexicana de Ciencias Pecuarias, 12(3), 186-204. https://doi.org/10.22319/rmcp.v12s3.5840. DOI: https://doi.org/10.22319/rmcp.v12s3.5840
Robles, C. A., Uzal, F. A. & Olaechea, F. V. (2011). Guía de muestreo para el diagnóstico de enfermedades en ovinos y caprinos. Instituto Nacional de Tecnología Agropecuaria (INTA). Pp. 33
Rodríguez-Molano, C. E., Pulido-Suárez, N. J. & Rodríguez-Montaña, A. (2018). Evaluación de tres extractos de plantas para inhibir el desarrollo de larvas de los parásitos gastrointestinales de los ovinos. Revista Cubana de Plantas Medicinales, 23(3).
Sánchez-Salgado, S. F., Castañeda-Ramírez, G. S., Sánchez, J. E. & Aguilar-Marcelino, L. (2021). Actividad nematicida in vitro de tres cepas de hongos comestibles de Pleurotus spp. contra Haemonchus contortus (L3) y Nacobbus aberrans (J2). Ibciencias, 4(1).
Sargison, N. D., Redman, E., Morrison, A. A., Bartley, D. J., Jackson, F., Naghra, G., Holroyd, N., Berriman, M., Cotton, J. A. & Gilleard, J. S. (2018). A method for single pair mating in an obligate parasitic nematode. International Journal for Parasitology, 48(2), 159-165. https://doi.org/10.1016/j.ijpara.2017.08.010. DOI: https://doi.org/10.1016/j.ijpara.2017.08.010
Scott, H., Gilleard, JS, Jelinski, M., Barkema, HW, Redman, EM, Avramenko, RW, ... & Uehlinger, FD (2019). Prevalence, fecal egg counts, and species identification of gastrointestinal nematodes in replacement dairy heifers in Canada. Journal of Dairy Science 102(9). https://doi.org/10.3168/jds.2018-16115. DOI: https://doi.org/10.3168/jds.2018-16115
Soca, M., Roque, E. & Soca, M. (2005). Epizootiología de los nematodos gastrointestinales de los bovinos jóvenes. Pastos y forrajes, 28(3). https://www.redalyc.org/pdf/2691/269121675001.pdf.
Soca, M., Simoón, L. & Roque, E. (2007). Árboles y nematodos gastrointestinales en bovinos jóvenes: Un nuevo enfoque de las investigaciones. Pastos y Forrajes, 30(5), 21-33. https://www.redalyc.org/articulo.oa?id=269120998002.
Szewc, M., De Waal, T. & Zintl, A. (2021). Biological methods for the control of gastrointestinal nematodes. The Veterinary Journal, 268, 105602. https://doi.org/10.1016/j.tvjl.2020.105602. DOI: https://doi.org/10.1016/j.tvjl.2020.105602
Zajac, A. M. & Garza, J. (2020). Biology, epidemiology, and control of gastrointestinal nematodes of small ruminants. Veterinary Clinics of North America: Food Animal Practice, 36(1), 73-87. https://doi.org/10.1016/j.cvfa.2019.12.005. DOI: https://doi.org/10.1016/j.cvfa.2019.12.005
Zaragoza-Vera, C. V., González-Garduño, R., Medina-Reynés, J. U., Berumen-Alatorre, A. C., Arjona-Jiménez, G., Zaragoza-Vera, M. & Aguilar-Caballero, A. J. (2017). Resistencia fenotípica de ovinos Blackbelly, Pelibuey y Katahdin contra nematodos gastrointestinales en el trópico húmedo de México. Avances de la investigación sobre producción de ovinos de pelo en México. Universidad Juárez Autónoma de Tabasco, Instituto Tecnológico de la Zona Maya e Instituto Tecnológico de Chiná. 232 p.
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2024 Ciencias Veterinarias y Producción Animal

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.
Aceptado 2024-07-03
Publicado 2024-08-08






