Desparasitación
selectiva dirigida de ovinos Dorper en una granja del centro de Tamaulipas, México
Targeted
selective deworming of Dorper sheep in a farm from the
central zone of Tamaulipas,
Mexico
Jesús
Humberto Reyna-Fuentes1,
Cecilia Carmela Zapata-Campos1*,
Juan Felipe de Jesús
Torres-Acosta3, Jaime
Salinas-Chavira1,
Luis Eliezer Cruz-Bacab2
Autor para correspondencia: cezapata@docentes.uat.edu.mx Fecha de recepción: 28 de junio de 2023
Fecha de aceptación: 1 de julio de 2023 Fecha de publicación: 11 de agosto de 2023
1Facultad de Medicina Veterinaria y
Zootecnia, Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas,
México. 2División Académica
de Ciencias Agropecuarias, Universidad Juárez Autónoma de Tabasco.
Villahermosa, Tabasco, México. 3Facultad de Medicina Veterinaria y
Zootecnia, Universidad Autónoma de Yucatán. Mérida, Yucatán, México.
RESUMEN
La
desparasitación selectiva dirigida (DSD) permite reducir la frecuencia de
animales tratados con antihelmínticos (AH) en rebaños de ovinos. Se desconoce
si la DSD pudiera funcionar en ovejas de raza Dorper,
que es una raza muy susceptible a nemátodos gastrointestinales (NGI). Este
estudio evaluó la estrategia de DSD en una granja de ovinos Dorper
en la zona centro de Tamaulipas, México. Primero, se determinó cuál AH podía
ser usado en la DSD. Se realizó el diagnóstico de resistencia con las tres clases
de AH de amplio espectro (levamisol, fenbendazol, ivermectina) y la combinación de levamisol y febendazol, mediante
la prueba de reducción de huevos en heces. Posteriormente, se estableció el
esquema DSD mensual durante 6 meses, en una población de entre 74 y 98 ovejas
adultas. A cada oveja se le determinó una vez al mes la FAMACHA©, condición
corporal (CC) y se obtuvo una muestra de heces de los animales flacos (CC ≤ 2)
o con mucosa pálida (FAMACHA© > 3). Las heces fueron procesadas mediante la técnica
de McMaster y los animales con ≥ 750 huevos de NGI en
heces fueron desparasitados. La granja tuvo una población de NGI multi-resistentes contra las tres clases de AH, pero la
combinación levamisol-fenbendazol mostró 100% de
eficacia, por lo que se usó en el estudio. El uso de la DSD redujo el uso de
AH, pasando de 100% de las ovejas tratadas en el semestre, a solo entre 33.63%
y 1.35% de los animales en cada mes. El uso del umbral ≥ 750 huevo por gramo de
heces (HPG) permitió mantener casi 75% de los animales flacos o de mucosa
pálida sin ser desparasitados. En conclusión, la DSD puede disminuir el uso de
AH en un rebaño de ovejas Dorper de la zona centro de
Tamaulipas, México.
Palabras claves: resistencia antihelmíntica, nemátodos,
desparasitación selectiva dirigida.
Abstract
Recent studies
showed that targeted selective treatment
(TST) allows reducing the frequency of
animals treated with anthelmintics (AH) in sheep flocks. It
is currently unknown if the
TST can be used with Dorper ewes, a breed that is
known to be susceptible to gastrointestinal nematodes
(GIN). This study evaluated a TST scheme in sheep farm in the
central zone of Tamaulipas.
The first thing was to
determine which AH could be
used for the TST. Thus, an AH resistance diagnosis was implemented for the three
classes of broad-spectrum AH (levamisole, fenbendazole and ivermectin) and the combination of levamisole and fenbendazole using respective faecal egg-count reduction tests. Subsequently, a monthly TST scheme was established
during 6 months, in a population of 74 to 98 adult ewes.
Each ewe was checked every
month for its FAMACHA© and body condition score (BCS) and a faecal
sample was obtained from all
animals with poor BCS (<2) or pale mucosae (FAMACHA© >3). Faecal samples were processed
by means of the McMaster
technique and those animals with GIN faecal egg counts
≥ 750 eggs per gramme of faeces (EPG) were dewormed. The farm had
a multi-resistant GIN population,
with resistance to the three
classes of AH, but the levamisole-fenbendazole
combination showed to be 100% effective against GIN, thus the combination was used in the
study. The implementation of the TST reduced the use of AH, going from 100% of ewes treated
every six months, to only
between 33.63% and 1.35% animals
in each month. The use of ≥ 750 EPG as a threhold for AH treatment allowed to maintain almost
75% of thin or pale animals without an AH treatment.
In conclusion, the TST scheme allowed to reduce the use of AH in a flock of Droper ewes
under the conditions of Tamaulipas, México.
Keywords: anthelmintic resistance,
nematode, targeted
selective deworming.
Introducción
La ovinocultura se lleva a cabo
principalmente en sistemas de pastoreo, por lo general con altas cargas de
animales, llegando en algunos casos al sobrepastoreo y la desnutrición
(Torres-Acosta & Hoste, 2008; Torres-Acosta et al., 2012a). Este
sobrepastoreo y el mal estado nutricional favorece los problemas parasitarios
en los rebaños ovinos, haciéndolos más frecuentes y con mayor impacto económico
para la producción ovina. Se estima que el impacto económico de la parasitosis
por nemátodos gastrointestinales (NGI) en la producción bovina en México es de
US$ 445.10 millones de dólares anuales, considerando una pérdida anual por
animal estimada de US$ 43.57 (Rodriguez-Vivas et al.,
2017). Las pérdidas económicas por NGI en caprinos en crecimiento en México se
han estimado en US$ 2.6 a 3.92 por animal (Gárate-Gallardo
et al., 2015; Torres-Acosta et al., 2004). En ovinos en crecimiento las
pérdidas se estiman en US$ 6.79 por animal (Retama-Flores et al., 2012). En
presencia de infecciones naturales de NGI la reducción en la ganancia de peso
en pequeños rumiantes varían entre 10% y 60%. Así también, se ha observado que
la aplicación de algun antihelmíntico (AH) en hembras
en lactación aumentan su producción lactea entre un 4
y 40%, siempre y cuando el AH sea eficaz (Charlier et al., 2014).
Los principales parásitos de
las ovejas adultas son los platelmintos (Fasciola
hepática, Moniezia expansa)
y los nematelmintos (nemátodos gastrointestinales, NGI). De estos últimos, se
han encontrado con mayor presencia Haemonchus
contortus, Teladorsagia
circumcincta, Cooperia
curticei, Trichostrongylus
colubriformis, T. vitrinus,
T. axei, Nematodirus
filicolis, N. spatiger,
Strongyloides papillosus,
Bunostomum trigonocephalum,
Trichuris ovis,
Oesophagostomum columbianum
y O. globulosa (Herrera et al., 2013; López et al., 2013). Las
afecciones por NGI son consideradas como causa importante de pérdida en la
productividad ovina, reducción de los niveles de producción y productividad,
alteraciones reproductivas y altos costos de control, además de la mortalidad
que pueden ocasionar (Charlier et al., 2014; Eisa et
al., 2017; Grisi et al., 2014; Kenyon et al., 2017; Rodríguez-Vivas et al.,
2017; Vercruysse et al., 2018).
Durante las últimas cuatro décadas, se desarrollaron antihelmínticos
(AH) comerciales con elevadas eficacias, amplio espectro y algunos con poder
residual. Estos productos han permitido al productor de ovinos disponer de
herramientas de control de NGI prácticas y a un costo aceptable (Molento et al., 2011). Sin embargo, el uso irracional de
las drogas antihelmínticas ha provocado el desarrollo de cepas de NGI
resistentes a los AH (FAO, 2003; Torres-Acosta et al., 2012a).
Para contrarrestar la problemática de la resistencia a los AH, se han
desarrollado estrategias orientadas a la desparasitación selectiva dirigida
(DSD). La DSD es una estrategia donde se selecciona a los animales que
requieren ser desparasitados, dejando a una parte del rebaño sin desparasitar
para reducir la presión de selección de NGI resistentes a los AH. Existen
varias metodologías que se han propuesto para realizar la DSD, pero en años
recientes se propuso el uso de la FAMACHA©, la condición corporal (CC) y la
cuenta de huevos de NGI en heces como una estrategia que permite reducir el
número de animales desparasitados (Charlier et al., 2014; Rosalinski-Moraes
et al., 2012; Torres-Acosta et al., 2009). Este método fue desarrollado
primeramente en caprinos (Torres-Acosta et al., 2014) y posteriormente se ha
validado en ovinos de pelo (Medina-Pérez et al., 2015).
La metodología de DSD utiliza la FAMACHA© como una estrategia para
identificar animales con mucosa palpebral pálida, que pudieran sugerir anemia.
Ante la escasa sensibilidad y especificidad del sistema FAMACHA©, se propuso
complementar ese sistema con la medición de la CC, pero este método también
pudiera ser poco específico. Por lo anterior, se propuso usar los dos primeros
criterios para obtener una muestra de heces de esos animales flacos o de mucosa
pálida y contar los huevos de NGI en heces.
Los estudios realizados por Torres-Acosta et al. (2014) en rebaños
caprinos y posteriormente por Medina-Pérez et al. (2015) en rebaños ovinos de
zonas tropicales húmedas de Tabasco demostraron que es posible mantener un alto
porcentaje de animales sin tratamiento contra NGI por varios meses o incluso
años. Sin embargo, el estudio en ovinos fue realizado con granjas donde se
producían animales Pelibuey, Katahdin,
Panza negra o sus cruzas. Hasta el momento, este sistema de DSD no ha sido
probado en ovinos de la raza Dorper, que se reconoce
como una raza ovina de pelo muy susceptible a las infecciones por NGI. Además,
se desconoce si se pueden usar los criterios de DSD que se han aplicado con otra razas de ovinos y en otros estados de México. El
objetivo del presente trabajo fue evaluar un sistema de desparasitación
selectiva dirigida en una granja de ovinos Dorper en
Tamaulipas, México.
Materiales y métodos
Lugar de estudio
El estudio se realizó en Ciudad Victoria, Tamaulipas, en el rancho
ovino Santa Cecilia (latitud 23°42’22.59” N y longitud 99°6’24.22” O), cuyo
propietario dio consentimiento para llevar a cabo la investigación en sus
instalaciones productivas.
El rancho Santa Cecilia se caracteriza por la producción de ovinos de
raza Dorper, cuenta con una población de 300 hembras.
Se encuentra localizado en la zona centro de Tamaulipas, cuya temperatura
promedio es de 24.0 °C mínima y máxima es de 39.5 °C respectivamente, y una
precipitación pluvial de 400 mm a 1100 mm. Presenta
un clima semi-cálido y subhúmedo, llegando a ser
semiseco o muy cálido y con humedad media (INEGI, 2017). El esquema de
desparasitación del rancho consistía en desparasitación de todos los animales
en pastoreo cada seis meses. La duración del trabajo de campo fue de 7 meses
(octubre a abril). Durante el estudio, el rango de humedad fue entre 68% y 76%,
así como una temperatura de 10 °C como mínima (diciembre) y máxima en el mes de
abril de 32 °C y precipitación pluvial en un rango de 18 mm a 26 mm (SMN,
2017).
Los animales fueron manejados de manera extensiva, por lo que
permanecieron en pastoreo durante 12 h en potreros de pasto estrella (Cinodon nlemfluensis)
sin suplementación y con agua ad libitum, mediante bebederos portátiles.
Durante la noche, fueron resguardados en instalaciones construidas de madera,
con techos de lámina galvanizada, con especificaciones de espacio vital
para esta especie.
Fase I. Diagnóstico de resistencia antihelmíntica
Antes de implementar cualquier sistema de desparasitación, sea
selectivo o no, se requiere identificar la droga que sea todavía eficaz para el
control de NGI. Por lo tanto, el primer paso para establecer el programa de DSD
fue realizar el diagnóstico de resistencia antihelmíntica (RA) de acuerdo a lo sugerido por Coles et al. (1992). Esto
sirvió para determinar la presencia de cepas de NGI resistentes o susceptibles
a los AH y de esta manera decidir que fármaco emplear en la DSD.
Selección de animales para la prueba de resistencia
antihelmíntica
Diseño experimental para el diagnóstico de la RA
El diagnóstico de RA se realizó en el mes de octubre, antes de iniciar
el esquema de DSD. El procedimiento usado para detectar NGI resistentes a los
AH, fue la Prueba de Reducción en el Conteo de Huevos Fecales (FECRT, por sus
siglas en inglés: Fecal Egg Count
Reduction Test), recomendado por la World Association for the Advacement
of Veterinary Parasitology (WAAVP) (Coles et al., 1992). Para el
diagnóstico de la RA se incluyeron en el estudio a 60 animales (> 6 meses de edad),
seleccionadas de la población de 300 hembras del rebaño de estudio, las cuales
se encontraban identificadas mediante el arete del SINNIGA (Sistema Nacional de
Identificación Individual del Ganado). Los criterios de inclusión para la
prueba de resistencia fueron: (a) ovejas que se encontraban en pastoreo y (b)
que no hayan recibido desparasitación 3 meses antes de la prueba (Coles et al.,
1992). Cabe mencionar que para poder seleccionar a la granja Santa Cecilia se
aseguró con el Ingeniero Agrónomo encargado y con el propietario que cumpliera
estrictamente el segundo criterio de inclusión.
Previo al inicio del experimento se recolectaron muestras de heces
directamente del recto (4 g) en bolsas de polietileno e identificados en forma
individual. Se realizó un primer examen coproparasitoscópico mediante la prueba
de McMaster, de acuerdo con la técnica mencionada por
Rodríguez-Vivas et al. (2011). Este muestreo sirvió para determinar que los
animales se encontraban parasitados y solo así, se incluirían en la prueba de
RA a los animales que presentaran al menos 150 huevos por gramo (HPG) de
heces (Coles et al., 1992). Los 60 animales analizados mediante coproparasitoscopía presentaron esta condición, por lo
tanto, se procedió a formar 4 grupos de 15 animales cada uno con diferente
tratamiento. El grupo 1 (levamisol), grupo 2 (fenbendazol), grupo 3 (ivermectina) y grupo 4 (testigo sin
tratamiento). La asignación de animales a los diferentes grupos se realizó por
conveniencia para que el promedio de HPG pre-tratamiento
de los diferentes grupos fuera semejante.
El día cero se colectaron las heces de cada uno de los animales
directamente del recto y las muestras fueron procesadas a través de la técnica
de McMaster modificada (Rodríguez-Vivas et al.,
2011), posteriormente, los animales de los grupos tratados se pesaron para determinar
la dosis del producto y se les aplicó el tratamiento AH con levamisol
a razón de 7.5 mg/kg de PV, vía subcutánea (SC) (Ripercol
®), ivermectina a razón de 0.2 µg/kg de PV (SC) (Ivomec®),
y fenbendazol 7 mg/kg de PV, vía oral (Panacur ®). Los pesajes y tratamientos se realizaron por la
mañana antes de consumir alimento y después de haber mantenido a los animales
dietados por 8 h al menos. Pasados 14 d post-tratamiento
se tomaron muestras de heces nuevamente a todos los animales, para determinar
mediante McMaster la cuenta de HPG de NGI. Esto
sirvió para determinar el porcentaje de reducción de huevos fecales ocurrido en
cada grupo.
Debido a que las poblaciones de NGI del rancho de estudio tuvieron multiresistencia contra los tres antihelmínticos estudiados,
se procedió a realizar una nueva Prueba de Reducción en el Conteo de Huevos
Fecales, pero esta vez usando la combinación levamisol
y fenbendazol (7.5 mg/kg vía SC y 5 mg/kg V0), como
lo indican Leathwick y Besier
(2014), ya que presentan espectro similar, pero mecanismo de actividad
distinto. Para ello, se realizó una nueva selección de 30 animales asegurándose
mediante su número de identificación que no hayan estado en la anterior prueba
de RA, y que presentaran las mismas caracteristicas
del primer experimento de RA, las cuales son las que sugiere Coles et al.
(1992). Se realizó nuevamente la metodología de diagnóstico de RA, descrita
anteriormente. Se formaron dos grupos (grupo levamisol/fenbendazol y grupo control sin tratamiento) de 15 animales
cada uno.
Fase II. Implementación del esquema de
desparasitación selectiva dirigida
Durante los 30 días previos a iniciar la estrategia de DSD, la
desparasitación del grupo de animales de estudio fue suspendida. La
implementación del esquema DSD comenzó en el mes de noviembre. Se seleccionó
una población entre 74 y 98 hembras de las 300 hembras del rebaño (> 1 año de edad, de distintas etapas fisiológicas (e.g. hembras lactantes, hembras gestantes, hembras vacías),
asegurándose mediante su identificación que no hayan participado en las dos
pruebas de RA. El número cambiante de animales fue debido a causas ajenas a los
autores. En estas ovejas se comenzó a usar un esquema de DSD. Esta consistió en
examinar una vez al mes a cada oveja por un periodo de 6 meses. La DSD, se
realizó de acuerdo a los criterios descritos por
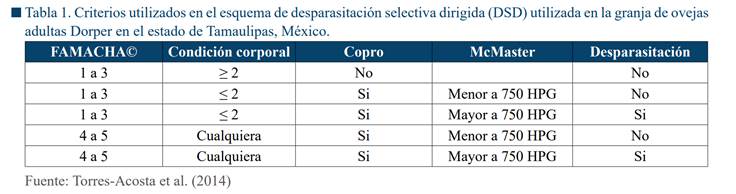
Torres-Acosta et al. (2014), los cuales se encuentran resumidos en la Tabla 1 y
se describen a continuación.
Palidez de mucosa determinado por FAMACHA©
Se determinó la coloración de la mucosa palpebral en ambos ojos de
todas las ovejas utilizando la tarjeta FAMACHA©. A los animales se les asignó
una calificación del 1 al 5, donde 1, 2 y 3 se consideraron como animales con
color de mucosa normal, y las calificaciones 4 y 5 se consideraron como animal
con mucosa pálida, consistente con algún grado de anemia (Torres-Acosta et al.,
2014).
Condición corporal (CC)
Se determinó la CC de las ovejas mediante la palpación del área
lumbar, asignando una calificación de 1 al 5 (Rusell,
1991). Los animales con CC 1 y 2 se consideraron como animales flacos, y los
animales con CC > 2 fueron clasificados como animales normales.
Examen coproparasitoscópico
Se tomó una muestra de heces directamente del recto a todos los
animales que tuvieron como resultado una FAMACHA© de 4-5 y una CC de 1-2 (Tabla
1). Las muestras de heces fueron conservadas en refrigeración hasta su
procesamiento en el área de análisis clínicos del Laboratorio de Diagnóstico de
la Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de
Tamaulipas. Cada muestra se mantuvo en bolsas plásticas debidamente rotuladas
con el número de animal y el nombre del rancho, para su procesamiento. Una vez
en el laboratorio, se realizó el conteo de HPG mediante la técnica de McMaster (Rodríguez-Vivas et al., 2011). Los animales
analizados que resultaron con un conteo ≥ 750 HPG de NGI del orden Strongylida fueron elegidos para ser desparasitados con una
combinación de levamisol y fenbendazol
(7.5 mg/kg vía SC y 5 mg/kg V0). Los animales con carga parasitaria < 750
HPG no se desparasitaron. Este umbral de desparasitación fue establecido de acuerdo a los resultados de estudio previos del sistema
de DSD en ovinos de pelo en Tabasco (Medina-Pérez et al., 2015) y Yucatán
(Soto-Barrientos et al., 2018). Los animales fueron marcados en el informe
mensual del productor, para resaltar la necesidad de mejorar su manejo, y así
evitar un mayor deterioro físico y los efectos negativos sobre la producción.
Análisis de datos
Resistencia antihelmíntica (RA)
Se calculó la media aritmética de las cargas de HPG en los grupos
tratados y control. Estas medias fueron usadas para calcular el porcentaje de
reducción del conteo de los huevos fecales mediante la fórmula:
[1-(HPGt / HPGc)]
x 100 sugerida por Coles et al. (1992).
Donde: HPGt: huevos por gramo de heces de
animales tratados y HPGc: huevos por gramo de heces
de animales control.
Se calculó el intervalo de confianza al 95% de la reducción de HPG
como sugieren Coles et al. (1992). Para esto, se utilizó el programa RESO.EXE.
La interpretación de la RA se obtuvo con base a las recomendaciones de
la World Association for the Advancement
of the Veterinary
Parasitology (WAAVP) (Coles et al.,1992), según los
siguientes criterios: (a) rebaño resistente si el porcentaje de reducción en el
conteo de los huevos fecales es menor del 95% y si el límite inferior del 95%
del intervalo de confianza es menor del 90%, (b) rebaño sospechoso si solamente
se cumple con uno de los dos criterios anteriores, y (c) rebaño susceptible si
no se cumple con ninguno de los dos criterios anteriores.
Evaluación del sistema de (DSD)
Cada animal examinado aportó un dato para cada uno
de los meses del estudio. Se determinaron las variables de respuesta, mediante coproparasitoscopía y el total de HPG ≥ 750 y que
necesitaron desparasitación durante los meses de muestreo.
Además, se utilizaron tablas de contingencia 2 x 2
para determinar la asociación entre la desparasitación y los valores de
FAMACHA© pálida (4-5) y CC baja (1-2), mediante el programa epidemiológico Epidat 3.1 (OPS/OMS, 2006). Asimismo, se determinó la
frecuencia de animales incluidos en la metodología DSD durante los 6 meses y
que se mantuvieron sin ser desparasitados, los que recibieron un tratamiento,
los que recibieron >2 tratamientos.
Finalmente, se utilizaron los datos de todos los
animales analizados para determinar el valor mínimo y máximo de HPG durante el
estudio, además de la mediana (50% de los eventos), el cuartil 3 (75% de los
eventos) y la proporción de eventos con ≥ 750 HPG y con ≥ 1 000 HPG.
Estos valores sirvieron para determinar si el umbral
de HPG utilizado para la desparasitación estaba permitiendo mantener una
mayoría de los animales sin desparasitación.
Resultados
Determinación de RA en la
granja de estudio
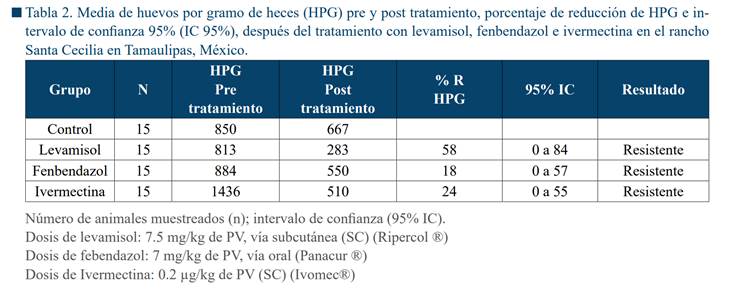
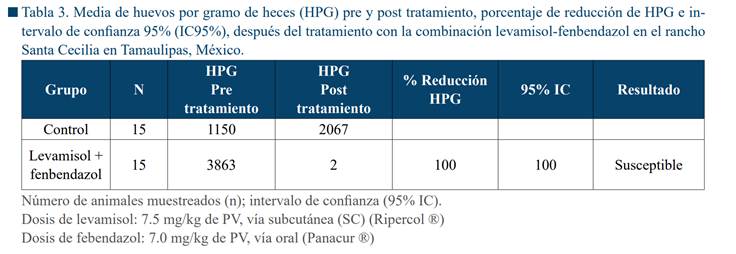
El estudio de RA mostró que la granja de estudio
presentaba cepas de NGI resistentes a las tres familias de AH con porcentajes
de reducción de 58% para levamisol, 18% para fenbendazol y 24% para ivermectina (Tabla 2). Por lo
anterior, se procedió a probar la eficacia de una combinación de levamisol y fenbendazol, donde se
observó una reducción del 100% en la cuenta de HPG de NGI (Tabla 3). Por lo
tanto, esto combinación fue sugerida para el tratamiento contra NGI en el
esquema de DSD.
Desparasitación selectiva
dirigida (DSD)
En el mes de noviembre se muestreó un total de 76 unidades
experimentales (Tabla 4), de los cuales 24 fueron analizadas mediante coproparasitoscopía, debido a que 17 presentaron la
condición de FAMACHA© 4 a 5 no importando la CC, y 7 presentaron FAMACHA© 1 a 3
y CC ≤ 2, mientras que 52 no se les tomó muestras de heces por presentar
FAMACHA© 1 a 3 y CC >2. Posteriormente, en diciembre aumentó la población a
98 animales, de los cuales, 45 ovinos presentaron FAMACHA© 4 a 5 con CC
cualquiera, y 29 animales FAMACHA© 1 a 3 con CC ≤ 2, por lo que fue un total de
74 animales a los que se les muestreó para determinar el número de HPG. El mes
de diciembre fue el mes con el menor número de animales que registraron
FAMACHA© 1 a 3 y CC > 2.

En el mes de enero se encontró el menor número de
animales con FAMACHA© 4 a 5 (4) y con CC cualquiera, además, se observó a 55
animales con FAMACHA© 1 a 3 y con CC ≤ 2, por lo que se muestrearon 59 animales
para determinar el número de HPG. Para el mes de abril se redujo la población a
74 animales, de los cuales se muestrearon 39 ovinos para detectar el número de
HPG. En este mes, 35 ovinos presentaron FAMACHA© 1 a 3 y CC >2, por lo que
no se necesitó muestrear heces. Sin embargo 32 animales presentaron FAMACHA© 4
a 5 con CC cualquiera y solo 7 animales registraron FAMACHA© 1 a 3 CC ≤ 2. En
general, los meses de noviembre y marzo fueron los meses con menor muestreo coprológico.
El mes de diciembre se muestreó al mayor número de animales (74) para HPG
(Tabla 4).
Con respecto al porcentaje de ovinos que recibieron
tratamiento antihelmíntico, el mes de noviembre presentó un valor de 22.44% de
hembras, con respecto al total de eventos analizados para ese mes con la
metodología de la DSD. Posteriormente, se aumentó a 33.63 % en el mes de dicembre, hasta obtener un valor del 1.35% en el mes de
abril (Tabla 4). Durante todo el periodo de estudio se registró un total de 542
eventos, de los cuales, 267 fueron analizados para determinar HPG, y de estos,
solo 67 fueron los eventos tratados (12.36 % de animales).
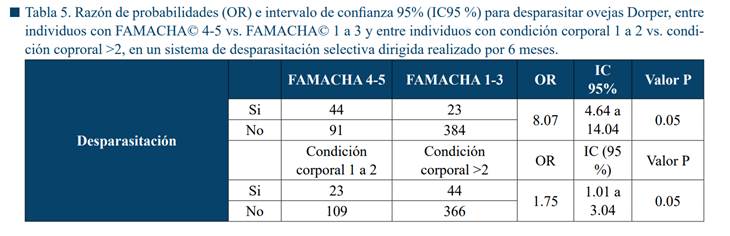
La Tabla 5 muestra la asociación estadística significativa entre la
variable FAMACHA© pálida (4 a 5) y la desparasitación (OR = 8.07, IC 95%: 4.64
a 14.04). Sin embargo, fue evidente que muchos animales expuestos, con FAMACHA©
pálida tuvieron cuentas de HPG < 750 HPG y no fueron desparasitados (67.4%).
Además, varios animales con FAMACHA© 1 a 3 si tuvieron cargas de ≥ 750 HPG y
fueron desparasitados (17%). Por otro lado, también se encontró una asociación
significativa entre la CC baja (1 a 2) y la necesidad de desparasitación (OR =
1.7, IC 95%: 1.01 a 3.02).
De todos los eventos analizados mediante coproparoscopía, ya sea por FAMACHA© 1-3 y CC ≤ 2 y
FAMACHA© 4-5 sin importar la CC (n = 267) (Tabla 4) se obtuvieron conteos de
HPG y se ordenaron de menor a mayor, encontrándose que el valor más bajo fue de
0 HPG y el más alto fue de 6500 HPG. La mitad de los eventos analizados (mediana)
tuvieron 200 HPG o menos. Además, el 75% de los eventos analizados (cuartil 3)
tuvieron hasta 750 HPG. De hecho, de todos los eventos con muestra de heces
solo el 23.97 % (n = 64) tuvieron ≥ 750 HPG y el 17.9% (n = 48) tuvieron ≥ 1000
HPG. De las 98 ovejas Dorper incluidas en el estudio,
se mantuvieron sin ser desparasitadas un total de 32 ovejas (32.6%), y se
desparasitaron 62 ovejas en una ocasión (63.2%), 2 ovejas en dos ocasiones
(2.04%) y 2 ovejas en >2 ocasiones (2.04 %).
Discusión
Resistencia antihelmíntica
En el presente estudio se demostró que la granja tenía poblaciones de
NGI resistentes a las tres clases de AH de amplio espectro. Este problema de
resistencia múltiple es un problema de carácter mundial. En España,
Martínez-Valladares (2012) encontró NGI multiresistentes
a tres fármacos pertenecientes a la familia de las lactonas macrocíclicas; así
también en regiones tropicales como Brasil, Cezar et
al. (2010) hallaron multiresistencia a nueve diferentes
antihelmínticos en rebaños ovinos. En México, la frecuencia de rebaños con
cepas multiresistentes a AH también ha sido reportada
(Aguilar-Caballero et al., 2009; Torres-Acosta et al., 2012a), en rebaños
ovinos de Chiapas (Ruiz-Zárate et al., 2013) y Tabasco (Herrera-Manzanilla et
al., 2017; Medina-Pérez et al., 2015), y de caprinos en Yucatán (Torres-Acosta
et al., 2012a). Es común encontrar granjas donde existen parásitos multiresistentes en zonas cálidas húmedas como Tabasco
(Herrera-Manzanilla et al., 2017; Medina-Pérez et al., 2015;
Torres-Acosta et al., 2012b). Este es el primer reporte de poblaciones de NGI multiresistentes en Tamaulipas. La elevada frecuencia de
NGI multiresistentes a AH pudo deberse a un
inadecuado manejo de los desparasitantes y a que los productores no acostumbran evaluar la eficacia de las drogas utilizadas en
el hato (Toro et al., 2014). Así también, cuando los productores sospechan de
la falla de la eficacia del fármaco tienden a aumentar la frecuencia de los
tratamientos (Jabbar et al., 2006). Esta práctica aumenta la presión de
selección de cepas resistentes y puede dar lugar a la resistencia a múltiples
fármacos (Cezar et al., 2010; Papadopoulos et al.,
2012).
Una de las estrategias que se utiliza en ranchos con cepas multi-resistentes a los AH es la combinación de
medicamentos AH. Este uso combinado se ha utilizado para mejorar la eficacia de
los tratamientos antihelmínticos en presencia de resistencia múltiple en un
rebaño (Cezar et al., 2010). Aunque en el presente
estudio funcionó bien la combinación de levamisol con
fenbendazol, como ha ocurrido en trabajos anteriores
en México (Medina-Pérez et al., 2015), esta estrategia no debe ser sobre-utilizada, ya que se puede llegar también a
resistencia de las combinaciones.
Desparasitación selectiva dirigida (DSD)
Los resultados obtenidos en este estudio demuestran que es posible
disminuir la cantidad de ovinos a tratar con AH en la zona centro del estado de
Tamaulipas. En lugar de desparasitar a todos los animales en el periodo de
estudio, en el primer mes solo se desparasitó al 22.44% y se redujo al 1.35%
para el último mes de muestreo, por lo que, en general solo se desparasitó al
12.36%.
Esto pudiera ayudar a mantener una proporción de parásitos del rebaño
en refugio, es decir, sin exponerlos a los desparasitantes (Kenyon et al.,
2009). Sin embargo, la reducción en el número de desparasitaciones disminuye la
probabilidad de desarrollar cepas resistentes a los AH, permitiendo mantener
baja la presión de selección de resistencia en los NGI (Gaba et al., 2010).
De esta forma, se podría usar el mismo AH por varios años, reduciendo
la frecuencia de NGI con alelos resistentes contra dicha droga. Aquellos
animales que no recibieron tratamiento y permanecen parasitados constituyen un
refugio para los NGI contra los AH, y van a depositar en los pastos huevos de
NGI, cuyas larvas infectantes provienen de parásitos no expuestos a los AH.
Esto significa que estas larvas ayudan a diluir los genotipos de NGI
resistentes a los AH. Esta dilución ocurriría por el consumo constante de NGI
no expuestos a los AH (NGI sensibles) que se pudieran aparear con los NGI
resistentes (Chan-Pérez et al., 2015; Kaplan, 2004; Van-Wyk
et al., 2006; Kenyon et al., 2009).
En este estudio, no solo se utilizó al método FAMACHA© como criterio
de desparasitación, sino que también se recurrió a evaluar la CC y la
eliminación de HPG en heces. Con esto se evita el uso frecuente de
desparasitaciones en animales con calificaciones de FAMACHA© 4-5, que tal vez
no tengan infecciones con NGI, sino problemas de desnutrición u otros
padecimientos relacionados con anemia (Torres-Acosta et al., 2014).
Así también, el solo uso de la CC como indicador para realizar la
desparasitación trae como consecuencia, desparasitar a animales sin tener
elevadas cargas de huevos de NGI, ya que la CC se encuentra influenciada por
muchos otros aspectos, tales como deficiencia en la nutrición o problemas de
manejo (Leask et al., 2013; Stafford et al., 2009).
El implementar los dos métodos anteriores, junto con la cuenta de
huevos (HPG), mejora la selección de animales a tratar, ya que el conteo de
huevos es un indicador de la cantidad de NGI presentes en el animal. Con el
sistema que se implementó, el conteo de HPG se limita a los animales que se
encuentran con FAMACHA© pálida o con baja CC, reduciendo la cantidad de
animales a los que se les necesita tomar una muestra y determinar su carga de
HPG. Al momento de realizar el McMaster, si se tiene
presente un nivel de HPG como umbral, (≥ 750 HPG), se puede dejar de contar los
huevos en el momento de alcanzar este umbral haciendo más eficaz el proceso
(Torres-Acosta et al., 2009).
Uno de los aspectos importantes del presente estudio fue demostrar que
el uso de la FAMACHA pálida (4 a 5) y la CC baja (1 a 2) permiten encontrar a
los animales con cargas de huevos en heces de ≥ 750. Sin embargo, fue evidente
que más de la mitad de las ovejas con FAMACHA© (4 a 5) no tuvieron cargas de ≥
750 HPG y algo semejante pasa con los animales de baja CC (1 a 2). Estos
resultados son similares a lo reportado por Torres-Acosta et al. (2014),
quienes enfatizan la importancia de tomar la muestra de heces y determinar la
cantidad de HPG antes de decidir desparasitar a las ovejas Dorper.
En el presente estudio se observó, que solo el 23.97% de las ovejas
excretaron cargas de ≥ 750 HPG. Esto claramente demuestra que la población de
NGI en los 267 eventos de ovejas Dorper con conteo de
huevos de NGI mostraba sobredispersión, con un mínimo
de 0 HPG, una mediana de 200 HPG (50% de los datos debajo de 250 HPG) y un
máximo de 6500 HPG. Este tipo de distribución es común para las poblaciones de
pequeños rumiantes. Por ejemplo, el trabajo de Herrera-Manzanilla et al.,
(2013), reportó que el 72.7% de las ovejas que fueron positivas a NGI,
solamente el 15.7% excretaron por arriba de los 700 HPG; Asi
también, Medina-Pérez et al., (2015), hallaron que del 53.1% de la población de
ovejas positivas a NGI, solamente el 15% tuvo cargas parasitarias por encima de
los 750 HPG; resultados semejantes encontró Torres-Acostaet
al., (2014), en Yucatán.
Esta sobredispersión puede deberse a
características genéticas del animal para la resistencia a infecciones por
nemátodos (Hoste et al., 2001). En general, es necesario subrayar que la DSD
basado en un umbral de desparasitación de ≥ 750 HPG es factible, ya que no
favoreció la presencia de animales afectados en su salud.
Por último, las ventajas de la DSD no solo consiste
en aumentar la cantidad de parásitos con genes susceptibles a los
desparasitantes, sino también permite ahorros en la cantidad de desparasitante
utilizado y mano de obra para desparasitar y más aún su uso en ranchos con
presencia de cepas multiresistentes (Charlier et al.,
2014; Lamberti et al., 2014; Leask et al., 2013).
Conclusiones
Con los resultados obtenidos en este estudio se muestra la presencia
de cepas multiresistentes de NGI en rebaños de ovinos
en la zona centro de Tamaulipas. El esquema de DSD redujo el uso de AH, pasando
de 100% de las ovejas tratadas en el semestre, a solo entre 33.63% y 1.35% de
los animales en cada mes. De los 98 animales incluidos en el estudio, el 32.6%
se mantuvo sin tratamiento los 6 meses del trabajo, 63.2% fueron tratados una
vez y 4.04% fueron tratados > 2 veces. El uso del umbral ≥ 750 HPG como punto
de corte para desparasitar permitió mantener casi 75% de los animales flacos o
de mucosa pálida sin ser desparasitados. Por lo tanto, la DSD puede disminuir
el uso de AH en un rebaño de ovejas Dorper en
condiciones de Tamaulipas, México.
Referencias
Aguilar-Caballero, A. J., Torres-Acosta, J. F. J.,
& Cámara-Sarmiento, R. (2009). Importancia de
parasitismo
gastrointestinal en ovinos y situación actual de la resistencia antihelmíntica
en
México. En R., Gonzalez-Garduño y A. C., Berumen-Alaforte,
Avances en el control de la
parasitosis gastrointestinal de ovinos en el trópico. México,
Universidad Autónoma de
Chapingo, (pp. 1-11).
Cezar,
A. S., Toscan, G., Camillo, G., Sangioni,
L. A., Ribas, H. O., & Vogel, F. S. F. (2010).
Multiple
resistance of gastrointestinal
nematodes to nine different drugs in a sheep flock in
southern Brazil. Veterinary
Parasitology, 173(1-2), 157-160.
https://doi.org/10.1016
/j.vetpar.2010.06.013
Chan-Pérez, J. I., Torres-Acosta, J. F. J., Rodríguez-Vivas, R. I.,
& Villegas-Pérez, S. L. (2015).
Reduction
of benzimidazole resistance in established Haemonchus contortus
populations in
goats using a single infection with a benzimidazole-susceptible isolate.
Journal of
Helminthology, 89(5), 641-645. https://doi.org/10.1017/S0022149X14000674
Charlier, J., Morgan, E. R., Rinaldi, L., Van-Dljk,
J., Demeler, J., Höglund,
J. Hertzberg, H., Van
Ranst, B., Hendricx, G., Vercruysse,
J., & Kenyon, F. (2014). Practices to optimise
gastrointestinal nematode control on sheep, goat
and cattle farms in Europe using targeted
(selective) treatments. Veterinary
Record, 175(10), 250-255.
https://doi.org/10.1136/vr.102512
Coles, G. C., Bouer, C., Borgsteede,
F. H. M., Geerts, S., Klei,
T. R., Taylor, M. A., & Waller, P.
J. (1992). World Association
for Advancement of Veterinary Parasitology
(W.A.A.V.P)
methods
for the detection
of anthelmintic resistance in nematodes of veterinary importance.
Veterinary
Parasitology, 44(1-2), 35-44. https://doi.org/10.1016/0304-4017(92)90141-U
Eisa, N. Z., Babiker,
S. A., & Abdalla, H. S. (2017). Impact of Natural Gastrointestinal
Parasitic
Infection
on Growth Performance and Economics of Production
of the Sudan Desert Sheep.
Journal
Veterinary Science Medical Diagnostic, 6, 1. URL:
https://www.scitechnol.com
veterinary-science-medical-diagnosis.php
EPIDAT: Programa para el análisis epidemiologico de datos. Versión 3.1 (2006). Consejeria de
Sanidad de Galicia. Organización Panamericana de la Salud (PS/OMS).
Universidad CES.
Colombia.
FAO, Organización de las Naciones Unidas para la
Agricultura y la Alimentación (2003).
Resistencia a los
antiparasitarios: estado actual con énfasis en América Latina. Dirección de
Producción y Salud Animal. Viale de lle Terme di Caracalla. [En línea]. Disponible en:
http://www.fao.org/docrep/006/Y4813S/Y4813S00.HTM.
Fecha de consulta: 9 de
noviembre de 2017.
Gaba, S., Cabaret, J., Sauvé, C., Cortet, J., &
Silvestre, A. (2010). Experimental and modeling
approaches to evaluate different aspects of the efficacy
of target selective treatment of
antihelmintics against sheep
parasite nematodes. Veterinary
Parasitology,171(3-4),
254-262. https://doi.org/10.1016/j.vetpar.2010.03.040
Gárate-Gallardo, L.,
Torres-Acosta, J. F. J., Aguilar-Caballero, A. J., Sandoval-Castro, C. A.,
Cámara-Sarmiento, R., & Canul-Ku, H. L.
(2015). Comparing different
maize supplementation
strategies
to improve resilience and resistance against gastrointestinal nematode
infections
in browsing
goats. Parasite, 22, 19. https://doi.org/10.1051/parasite/2015019
Grisi, L., Cerqueira-Leite,
R., de-Souza Martins, J. R .,
Medeiros-de-Barros, A. T,, Andreotti, R.,
& Duarte-Cançado, P. H. (2014). Reassessment
of the potential
economic impact of cattle
parasites in Brazil. Brazil Journal Veterinary Parasitology, 23(2),
150-156. https://doi.
org/10.1590/S1984-29612014042
Herrera-Manzanilla, F. A., Ojeda-Robertos, N. F., González-Garduño, R., Cámara-Sarmiento,
R., &
Torres-Acosta, J. F. J. (2017). Gastrointestinal nematode
populations with multiple
anthelmintic resistance in sheep
farms from the hot humid
tropics of Mexico. Veterinary
Parasitology, (Amst). 9, 29-33. https://doi.org/10.1016/j.vprsr.2017.04.007
Herrera, L. O., Rios, L.
O., & Zapata, R. S. (2013). Frecuencia de la infección por nemátodos
gastrointestinales en ovinos y caprinos de 5 municipios de Antioquia. Revista
MVZ
Cordova, 18(3), 385-386. URL:
https://www.redalyc.org/articulo.oa?id=69329149015
Hoste, H., Frileux, Y.
L. E., & Pomaret, A. (2001). Distribution
and repeatability of faecal egg counts
and blood parameters
in dairy goats naturally infected with gastrointestinal nematodes.
Research
in Veterinary Science, 70,
57-60. https://doi.org/10.1053/rvsc.2000.0442
INEGI, Instituto Nacional de Estadística y Geografía
(2017). Anuario estadístico y geográfico de
Tamaulipas. Instituto
Nacional de Estadística y Geografía. P 521. [En línea]. Disponible en:
http://www.datatur.sectur.gob.mx/ITxEF_Docs/TAMS_ANUARIO_PDF.pdf. Fecha
de
consulta: 15 de febrero
de 2018.
Jabbar, A., Iqbal, Z., Kerboeuf, D., Muhammad, G., Khan, M. N., & Afaq, M. (2006).
Anthelmintic resistance: the state of play
revisited. Life Science, 79(26), 2413-2431.
https://doi.org/10.1016/j.lfs.2006.08.010
Kaplan, R. M. (2004). Drug
resistance in nematodes of veterinary importance:
a status report.
Trends
in Parasitology, 20(10), 477-481. https://doi.org/10.1016/j.pt.2004.08.001
Kenyon, F., Greer, A. W.,
Coles, G. C., Cringoli, G., Papadopolus,
E., Cabaret, J., Berrag, B.,
Varady, M., Van Wyk, J. A., Thomas, E., & Vercruysse, J. (2009). The role of target selective
treatments in the development
of refugia-based approaches to the
control of
gastrointestinal nematodes of
small ruminants. Veterinary Parasitology,
164(1), 3-11.
https://doi.org/10.1016/j.vetpar.2009.04.015
Kenyon, F., Hutchings, F.,
Morgan-Davies, C., Dijk, J. V., & Bartley, D. J.
(2017). Worm
Control in Livestock: Bringing Science to the
Field. Trends in Parasitology,
33(9), 669-677.
https://doi.org/10.1016/j.pt.2017.05.008
Lamberti, P. F, Amadori, M., Anezi-Junior,
P. A., Weber, A., Skrebsky, A., Sangioni,
L. A., &
Flores, V. F. A. (2014). Improving liveweight gain of lambs infected
by multidrug-
resistant nematodes using a
FECRT-based schedule of treatments. Parasitology Research,
113(6), 2303-2310. https://doi.org/10.1007/s00436-014-3885-x
Leask,
R., Van-Wyk, J. A., Thompson, P. N., & Bath, G.
F. (2013). The effect of application
of
FAMACHA© system on selected production parameters in sheep. Small Ruminant
Research, 110(1), 1-8. https://doi.org/10.1016/j.smallrumres.2012.07.026
Leatwick,
D.M., Besier, R.B. 2014. The
management of anthelmintic resistance in grazing
ruminants in Australasia-Strategies and experiences. Veterinary
Parasitology, 204, 44-54.
https://doi.org/10.1016/j.vetpar.2013.12.022
López, R. O. A., González, G. R., Osorio, A. M. M.,
Aranda, I.E., & Díaz, R. P. (2013). Cargas y
especies prevalentes de nemátodos gastrointestinales en ovinos de pelo
destinados al abasto. Revista
Mexicana Ciencia Pecuaria, 4(2), 223-234. URL: http://www.scielo.org.mx/scielo.
php?pid=S2007-11242013000200008&script=sci_arttext&tlng=en
Martínez-Valladares, M., Famularo,
M., Fernández-Pato, N., Cordero-Pérez, C., Castañón-
Ordóñez, L., & Rojo-Vázquez, F. (2012). Characterization
of a multidrug resistant
Teladorsagia circumcincta isolate
from Spain. Parasitology Research,
110(5), 2083-2087.
https://doi.org/10.1007/s00436-011-2753-1
Medina-Pérez, P., Ojeda-Robertos,
N. F., Reyes-García, M. E., Cámara-Sarmiento, R., &
Torres-Acosta, J. F. J.
(2015). Evaluation of a targeted selective treatment scheme to control
gastrointestinal nematodes of
hair sheep under hot humid
tropical conditions. Small
Ruminant Research, 127, 86-91. https://doi.org/10.1016/j.smallrumres.2015.02.021
Molento,
B. M., Fortes, F. S., Pondelek,
D. A. S., Borges, F. A., Chagas, A. C. S., & Torres-
Acosta, J. F. J. (2011). Challenges of nematode control in ruminants: Focus on Latin
America. Veterinary Parasitology,
180(1-2), 126-132. https://doi.org/10.1016/
j.vetpar.2011.05.033
Papadopoulos, E., Gallidis, E., & Ptochos, S. (2012). Anthelmintic
resistance in sheep in Europe:
A selected
review. Veterinary Parasitology, 189(1),
85-88. https://doi.org/10.1016/j.vetpar.2012.03.036
Retama-Flores, C. Torres-Acosta, J. F. J.,
Sandoval-Castro, C.A., Aguilar-Caballero, A.J.,
Cámara-Sarmiento, R., & Canul-Ku, H. L.
(2012). Maize supplementation
of Pelibuye sheep in
a silvopastoral system: fodder selection, nutrient intake and resilience againts gastrointestinal
nematodes. Animal, 6, 1, 145-153. https://doi.org/10.1017/S1751731111001339.
Rodríguez-Vivas, R. I., Domínguez-Alpizar, J. L. & Cob-Galera,
L. A. (2011). Técnicas diagnósticas
de parasitología
veterinaria. Yucatán, México: Universidad Autónoma de Yucatán. Mérida.
48 Pp.
Rodríguez-Vivas, R. I., Grisi, L., Pérez-de-León, A.
A., Silva-Villela, H., Torres-Acosta, J. F. J.,
Fragoso-Sánchez, H., Romero-Salas, D., Rosario-Cruz, R., Saldiema, F., & García-Carrasco,
D. (2017). Potential economic
impact assessment for cattle parasites in Mexico. Revista
Mexicana de Ciencias Pecuarias, 8,
61-74. URL: https://www.redalyc.org/ pdf/2656/265649561007.pdf
Rosalinski-Moraes,
F., Griebeler-Fernandes, F., Munaretto,
F., Solange O., Wilmsen, M. O.,
Welzel, P. M., & Ferreira, M. A. (2012). Método FAMACHA©, escore
corporal e de
diarreia
como indicadores de tratamento anti-helmíntico
seletivo de ovelhas em reprodução.
Bioscience Journal, 28, 1015-1023. URL:
http://www.seer.ufu.br/index.php/biosciencejournal/
article/view/17290
Ruiz-Zárate, F., Cruz-Velázquez, F., Aguilar-Caballero,
A. J., Olivas-Salazar, R., López-Trujillo,
R., Torres-Hernández, G., & Cuéllar-Ordaz, A. (2013). Resistencia
helmíntica de ovinos
Katahdin y Pelibuey en Villacorzo, Chiapas, México. Agraria, 10,
109-114. URL:
http://redi.uady.mx/handle/123456789/1051
Rusell, A. (1991). Body condition scoring of sheep.
In Sheep and goat practice. Bailliere, Tindall,
London:
Boden, E. 3-10 pp.
SMN, Sistema Meteorologico Nacional (2017). Resumenes mensuales de temperatura y lluvia. [En
línea]. Disponible en: http://www.smn.go.mx/es/climatologia/temperaturas-y-lluvias/
resumenes.mensuales-de-temperatura y
lluvias. Fecha de consulta: 15 de febrero de 2018.
Soto-Barrientos, N., Torres-Acosta, J. F. J.,
Chan-Pérez, J. I., España-España, E.,
Novelo-Chi, L., Palma-Ávila, I., Ceballos-Mendoza, A. C.,
Sarabia-Hernández, J. A.,
Santos-Ricalde R. H., & Cámara-Sarmiento, R. (2018). Body condition score is the best
criterion to find ewes with high
faecal worm egg counts in hair-sheep
sheep farms using a
targeted selective treatment under
hot tropical conditions. Small
Ruminant Research,
167, 92-99. https://doi.org/10.1016/j.smallrumres.2018.08.011
Stafford, K. A., Morgan, E. R., & Coles, G. C.
(2009). Weight-based target
selective treatment
of
gastrointestinal nematodes in a commercial
sheep flock. Veterinary Parasitology,
164(1), 59-65. https://doi.org//j.vetpar.2009.04.009
Toro, A., Rubilar, L., Palma, C., & Pérez, R.
(2014). Resistencia antihelmíntica en nemátodos
gastrointestinales de ovinos tratados con ivermectina y fenbendazol.
Archivos de Medicina Veterinaria, 46(2), 247-252. URL:
https://scielo.conicyt.cl/scielo.
php?pid=S0301-732X2014000200010&script=sci_arttext
Torres-Acosta, J. F. J., Jacobs D. E.,
Aguilar-Caballero A., Sandoval-Castro, C., May-Martinez,
M., &
Cob-Galera, L. A., (2004). The effect of supplementary
feeding on the resilience and resistance
of browsing Criollo kids against natural gastrointestinal nematode
infections during
the rainy season in
tropical Mexico.Veterinary Parasitology, 124, 217-238.
https://doi.org/10.1016/j.vetpar.2004.07.009
Torres-Acosta, J. F. J., & Hoste, H. (2008).
Alternative or improved methods to limit
gastro-
intestinal parasitism in grazing sheep and goats. Small Ruminant Research, 77(2),
159-173.
https://doi.org/10.1016/j.smallrumres.2008.03.009
Torres-Acosta, J. F. J., Cámara-Sarmiento, R.,
Aguilar-Caballero, A. J., Canul-Ku, H. L., &
Pérez-Cruz, M. (2009). Estrategias de desparasitación selectiva
dirigida. En Gonzalez-
Garduno, R., Berumen-Alaforte, A.C. (Ed.), Avances en
el control de la parasitosis
gastrointestinales de ovinos en el trópico (pp. 1-14). Tabasco, México:
Universidad
Autónoma de Chapingo,
C.R.U.S.E.
Torres-Acosta, J. F. J., Mendoza-de-Gives, P., Aguilar-Caballero, A. J., & Cuéllar-Ordaz,
J. A.
(2012a). Anthelmintic resistance in sheep farms: Update of
the situation in the American.
Veterinary Parasitology, 189(1),
89-96. https://doi.org/10.1016/j.vetpar.2012.03.037
Torres-Acosta, J. F. J., Soto-Barrientos, N.,
González-Hernández, J., Pérez-Cruz, M., Chan-Pérez,
I., Rodríguez-Vivas, R. I., & Aguilar-Caballero, A. J. (2012b).
Desparasitación selectiva
dirigida: una nueva manera de desparasitar ovinos y caprinos. Mérida,
Yucatán, México:
XXXVI Congreso Nacional
de Buiatría. 112 pp.
Torres-Acosta, J. F. J., Pérez-Cruz, M., Canul-Ku, H. L., Soto-Barrientos, N., Cámara-Sarmiento, R.,
Aguilar-Caballero, A. J., & Hoste, H. (2014). Building
a combined targeted
selective
treatment scheme against
gastrointestinal nematodes in tropical goats. Small Ruminant
Research, 121(1), 27-35. https://doi.org/10.1016/j.smallrumres.2014.01.009
Van-Wyk, J. A., Hoste, H.,
Kaplan, R. M., & Besier, R. B. (2006). Target
selective treatment for
worm
management-how do we sell rational programs
to farmers. Veterinary Parasitology,
139(4), 336-346. https://doi.org/10.1016/j.vetpar.2006.04.023
Vercruysse, J., Charlier J., Van-Dijk,
J., Morgan, E. R., Geary, T., von-Samson-Himmelstjerna,
G.,
& Claerebout, E. (2018). Control of helminth ruminant
infections by 2030. Parasitology,
145, 1655-1664.
https://doi.org/10.1017/S003118201700227X