Efectos del sulfato de cobre y romet®-30 en células mucosas branquiales del bagre ictalurus punctatus
Effects of copper sulfate and Romet®-30 on gill mucous cells from channel catfish Ictalurus punctatus
Jaime Luis Rábago-Castro1, Jesús Genaro Sánchez-Martínez2*, Jorge Loredo-Osti2, Ned Iván de la Cruz-Hernández2, Roberto Pérez-Castañeda2
Autor para correspondencia: jgsanchez@docentes.uat.edu.mx / Fecha de recepción: 28 de junio de 2023
Fecha de aceptación: 16 de julio de 2023 / Fecha de publicación: 11 de agosto de 2023
1Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México.
2Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México.
![]()
ISSN electrónico: 2992-7501 1(1), 13 - 20 (Jul - Dic 2023)
https://doi.org/10.29059/cvpa.v2i2.6
Resumen
Con el objetivo de estudiar los efectos del tratamiento con sulfato de cobre y Romet®-30 sobre el número y composición de células mucosas branquiales (neutras y ácidas) se expusieron alevines de bagre de canal (Ictalurus punctatus) sanos durante once semanas a tratamientos profilácticos intermitentes de sulfato de cobre (en baños) o Romet®-30 (en el alimento). Cada semana se tomaron muestras del segundo arco branquial, se procesaron histológicamente y se tiñeron con ácido peryódico Schiff (PAS) y azul alcián a pH de 2.5. Los resultados del estudio mostraron un incremento significativo en las células mucosas con reacción ácida de los peces expuestos al sulfato de cobre, lo cual sugiere la respuesta del tejido al compuesto.
Palabras clave: sulfato de cobre, histoquímica, Ictalurus punctatus, células mucosas.
Abstract
With the aim to study the effects of treatment with copper sulfate and Romet®-30 on the composition and number of gill mucous cells (neutral, acidic and totals), healthy channel catfish fingerlings (Ictalurus punctatus) were exposed for eleven weeks to intermittent prophylactic doses of copper sulfate (in baths) or Romet®-30 (in feed). Each week, samples of the second gill arch were processed for histology and stained with PAS-AB2 (periodic acid Schiff and alcian blue, pH of 2.5). The study results showed a significant increase in mucous acidic cells of fish exposed to copper, which suggest the reaction to copper sulfate.
Keywords: copper sulfate, histochemical, Ictalurus punctatus, mucous cells.
Introducción
En la actualidad, diversos compuestos químicos son empleados habitualmente en la acuacultura como desinfectantes, terapéuticos o fertilizantes con el fin de prevenir enfermedades. No obstante, algunos de estos productos provocan diversos efectos negativos en las branquias de los peces
(De Kinkelin et al., 1991; Haddeland et al., 2021). Por ejemplo, el sulfato de cobre se usa en estanques de bagre de canal, Ictalurus punctatus y otras especies como parasiticida (Rowland et al., 2009; Tavares-Dias, 2021), algicida (Han et al., 2001) así como en el control del mal sabor. Sin embargo, se ha señalado que la exposición al cobre produce alteraciones de las láminas branquiales, cambios inmunológicos (Khangarot & Tripathi, 1991), alteraciones en la reproducción (Moosavi & Shamushaki, 2015), así como una disminución de la tasa de crecimiento (Kim & Kang, 2004).
De igual forma, el uso de antibióticos es una práctica común en los sistemas acuícolas para el tratamiento de enfermedades o su profilaxis. El Romet®-30 (principio activo ormetoprim y sulfadimetoxina) es uno de los pocos quimioterapéuticos permitidos para su uso en peces para consumo, especialmente en bagres de canal (Ictalurus punctatus).
En los peces y otros organismos acuáticos, las branquias son órganos que están en contacto permanente con el agua, y cuya composición celular puede reaccionar a la presencia de diversos compuestos, pudiendo servir estas reacciones como bioindicadores ambientales (Cabillon & Lazado, 2019; Lazado et al., 2020) o como herramientas durante el manejo de peces en granjas de cultivo (Persson et al., 2021).
El epitelio branquial comprende diferentes tipos de células, como las células del pavimento, las células de cloro y las células mucosas (Pereira & Caetano, 2009). Las células mucosas son grandes, presentan un voluminoso citoplasma que contiene gránulos secretores de moco, y se encuentran distribuidas en toda la branquia, pero en especial en el borde lamelar eferente (Smith et al., 2018). Las células mucosas pueden caracterizarse por el tipo de mucinas producidas por sus gránulos citoplasmáticos, cuya composición varía cuando las branquias se exponen a factores irritantes o ambientales (Osório et al., 2022). Estas mucinas llevan a cabo diferentes funciones físicas, bioquímicas, inmunológicas, de difusión, interacción con patógenos y estrés (Benktander et al., 2021), de protección contra sustancias tóxicas (Palma Leotta et al., 2017) y otras funciones de naturaleza etológica y ambiental (Reverter et al., 2018).
En histología, el estudio con microscopía de luz de las células mucosas se puede llevar a cabo con diferentes tinciones. Por ejemplo, la tinción histoquímica con ácido peryódico Schiff (PAS) y azul alcián (AB) a pH de 2.5, se emplea en la caracterización de las células mucosas de los peces, e indica los distintos tipos de mucinas (Monteiro et al., 2010). Esta tinción separa los glicoconjugados ácidos (glucoconjugados carboxilados y/o sulfatados) de los tipos neutros (Mowry, 1956), produciendo un color magenta, debido a la reacción con el ácido peryódico, o bien un color azul en caso de que las mucinas sean ácidas, al reaccionar con el azul alcián (Harris et al., 1973).
Se han realizado estudios histoquímicos sobre los efectos agudos o permanentes de diversos compuestos de metales pesados, compuestos tóxicos o terapéuticos en peces sobre las células mucosas branquiales (Gao et al., 2023), sin embargo, en muchos casos, tales bioensayos emplean exposiciones agudas o crónicas, los cuales no son comunes en la acuacultura; es decir, generalmente los peces están expuestos de manera intermitente a los compuestos, con períodos sin tratamiento, los cuales pueden llevar a la recuperación de los tejidos expuestos.
Por lo tanto, el objetivo de este estudio fue evaluar los efectos del sulfato de cobre o Romet®-30 en el número y tipo de células mucosas branquiales de juveniles de bagre de canal cuando estos compuestos se administran de forma profiláctica e intermitente.
Material y métodos
El estudio se llevó a cabo en la Facultad de Medicina Veterinaria y Zootecnia, “Dr. Norberto Treviño Zapata” de la Universidad Autónoma de Tamaulipas. Se instalaron seis tanques redondos de plástico, con drenaje central, y se llenaron hasta un volumen de 50 L, manteniendo un aporte continuo de agua de pozo y aireación mediante dos piedras de aire conectadas a mangueras, y estas a un soplador de 1 H.P. Doscientos diez juveniles (7.5-10.0 cm de longitud furcal) de bagre de canal, clínicamente sanos y provenientes de una granja de la región se distribuyeron al azar en cada uno de los 6 tanques (n = 35).
Los tanques se organizaron en 3 grupos, cada uno con 35 organismos, y con dos repeticiones por tratamiento. Durante once semanas, los peces del primer grupo recibieron una dosis terapéutica diaria de Romet®-30 (50 mg/kg) mezclado en el alimento. Otro grupo de peces fue expuesto dos veces por semana a un baño de sulfato de cobre (1.5 ppm) durante 1 hora. El tercer grupo quedó como control y no recibió ningún tratamiento. Los peces fueron alimentados dos veces al día con una dieta comercial específica para la especie y talla. Se tomaron muestras semanales de un organismo de cada uno de los seis tanques durante once semanas.
El traslado, aclimatación, alimentación, densidad, flujos, calidad del agua, captura, manejo y eutanasia se acataron estrictamente para cumplir las normativas de bioética y bienestar animal. Para realizar la eutanasia, los peces fueron colocados en una solución de 120 ppm de benzocaína, hasta que no se observara la respiración. Inmediatamente se diseccionó la segunda holobranquia del lado izquierdo, se fijó en formol al 10%, y se procesó subsecuentemente mediante los métodos histológicos estandarizados, haciendo cortes de 4-6 µ de grosor, los cuales se tiñeron con ácido peryódico Schiff (PAS) y azul alcián (AB) a un pH 2.5; los cortes de branquias se montaron y se examinaron mediante microscopía óptica. Los conteos de células mucosas branquiales y la composición de glicoproteínas mucosas se realizaron de acuerdo con Sánchez et al. (1997).
De manera breve, se realizó el conteo de todas las células mucosas con reacción ácida o neutra presentes en todo el arco branquial, descartando aquellas con reacción mixta. Con el azul alcián, el citoplasma de las células mucosas se tiñe de color azul, mientras que con la tinción peryódica de Schiff, el citoplasma se tiñe de magenta (Smith et al., 2018). Para el análisis estadístico se hizo una comparación mediante una prueba de Chi cuadrada, de la frecuencia de células ácidas, neutras y totales de los tres grupos, empleándose el software STATISTICA®.
Resultados
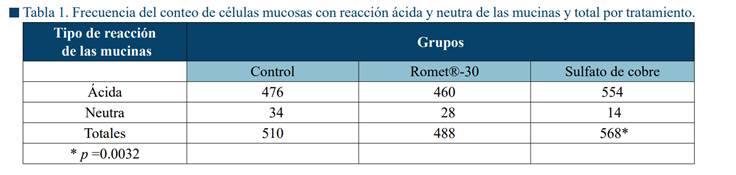
La mayoría de las células mucosas con reacción neutra o ácida, se observaron en los espacios interlamelares (Fig. 1). La Tabla 1 muestra la frecuencia del conteo de células mucosas con reacción ácida, neutra y el total en los tres grupos y durante las once semanas de tratamiento.
Los peces expuestos a sulfato de cobre (Tabla 1) mostraron el mayor número de células con reacción ácida, un menor número de células con reacción neutra, pero un total superior a los restantes grupos.
Esto indica por un lado valores de hiperplasia en el total de las células mucosas del grupo expuesto al cobre, cuyo aumento se reflejó en un cambio mayor en la composición de las mucinas hacia una reacción ácida. Por otro lado, los peces alimentados con Romet®-30 exhibieron el valor más bajo (reacción mucosa y total). Las células con reacción neutra fueron más altas en el grupo de control, seguidas de Romet®-30 y sulfato de cobre.
La prueba de Chi cuadrada
mostró una asociación significativa (p = 0.0032) entre los tratamientos
y el tipo de célula, observándose en los peces expuestos a sulfato de cobre los
valores más altos de células mucosas con reacción ácida. 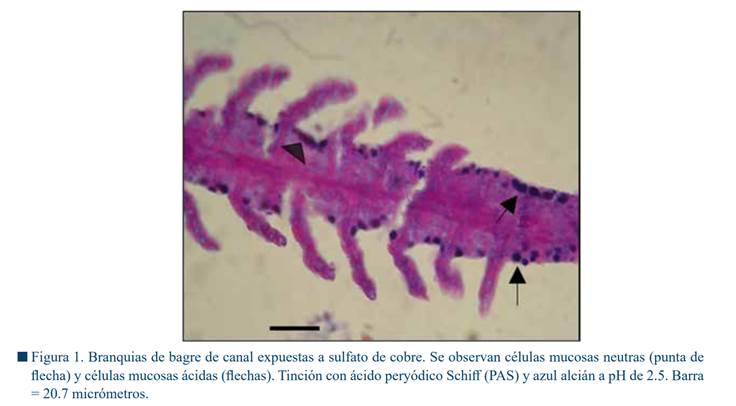
Discusión
En el presente estudio, la hiperplasia de las células mucosas ácidas y totales de los peces expuestos al sulfato de cobre indica una reacción del tejido expuesto; este tipo de lesión se puede presentar bien sea en enfermedades de naturaleza infecciosa o no infecciosa, pudiendo también ocasionar una hipertrofia (Patología en Acuicultura, 2023). Las branquias de los peces son órganos altamente vascularizados cuya localización externa aumenta su susceptibilidad a los agentes irritantes, tales como gases, materias en suspensión o disueltas (Richardson et al., 1983), pudiendo servir como bioindicadores de sustancias tóxicas y xenobióticos (Carvalho et al., 2020). Diversos estudios sobre los efectos crónicos, agudos o subletales de la suspensión de sólidos y sustancias en peces también confirman daños branquiales y un aumento en el número de células mucosas (Nimet et al., 2020).
En los peces, las respuestas a exposiciones crónicas al cobre y otros metales pueden incrementar la secreción de mucus y el número de células mucosas (Benktander et al., 2021), como en el presente reporte. Sin embargo, los resultados de algunos estudios discrepan de los hallazgos del presente estudio. Por ejemplo, Ostaszewska et al., (2016) observaron hiperplasia y un aumento en el número de células mucosas con reacción ácida en peces expuestos a nanopartículas de plata, pero en aquellos expuestos al cobre se encontró una disminución en el número de células mucosas.
En una amplia revisión de la literatura sobre los efectos del sulfato de cobre en la acuacultura, Tavares-Dias (2021) describe estudios donde se indican los efectos subletales y letales del sulfato de cobre en las branquias de diversas especies de peces, donde señalan a la hipertrofia de las células mucosas como una de las alteraciones en este tejido.
De acuerdo con este mismo reporte, las células mucosas reaccionan de manera inmediata a productos químicos en el agua secretando grandes cantidades de moco, sirviendo como una capa protectora.
La productividad en la acuicultura de peces puede verse afectada por el uso de compuestos químicos debido a que las alteraciones en las células branquiales y en particular de las mucosas pueden modificar el intercambio gaseoso, la osmorregulación, la defensa, la reproducción y la excreción de sustancias (Dang et al., 2020).
En el caso particular del cobre se ha señalado que debe ser usado cuidadosamente, ya sea como profiláctico o terapéutico, ya que, si la concentración sobrepasa los límites seguros, los peces pueden ser afectados de manera aguda o a largo plazo (Tavares-Dias et al., 2011).
En el presente estudio, a pesar de que los organismos experimentales tuvieron intervalos sin exposición al sulfato de cobre, al parecer este tiempo no fue suficiente para la recuperación de las células de la mucosa branquial hacia una reacción neutra de sus mucinas o no causar hipertrofia. Al respecto, van den Heuvel et al. (2000) señalan que la recuperación a la normalidad de las branquias de los peces después de un efecto irritante puede demorar entre tres y diez meses.
En el caso del efecto del Romet®-30, no se observaron diferencias significativas, lo que indica que el empleo de dicho producto de manera profiláctica e intermitente, no causa alteraciones histoquímicas en las células de la mucosa branquial.
Las alteraciones branquiales son usadas como biomarcadores de la calidad del agua empleando usualmente tinciones como hematoxilina y eosina donde es posible la cuantificación de las células mucosas (Marinović et al., 2021). Sin embargo, la tinción con azul alcián permite una caracterización más precisa de las células mucosas, pero se sugiere que, además, sea empleada junto con el ácido peryódico, ya que de esta manera se contabiliza una reacción neutra, pudiendo servir como una herramienta ante los posibles cambios en la composición de estas células a lo largo del tiempo.
Conclusiones
El uso profiláctico e intermitente de sulfato de cobre a dosis terapéuticas en baños tuvo un efecto significativo negativo en la composición y el número de células de la mucosa branquial en juveniles de bagre, pero el Romet®-30 no causa estas alteraciones.
Agradecimientos
Los autores desean agradecer al Consejo Nacional de Ciencia y Tecnología (CONACYT) por su apoyo para la realización de este estudio, así como a Fernando Gómez-Castañeda de la piscifactoría Acuamex, Abasolo, Tamaulipas, México, por proporcionar los peces para este estudio.
Referencias
Benktander, J., Sundh, H., Sundell, K., Murugan, A. V. M., Venkatakrishnan, V., Padra, J. T., Kolarevic,
J., Terjesen, B. F., Gorissen, M., & Lindén, S. K. (2021). Stress impairs skin barrier
function and induces α2-3 linked N-acetylneuraminic acid and core 1 O-glycans on skin mucins in Atlantic Salmon, Salmo salar. International Journal of Molecular Sciences, 22(3), 1488. https://doi.org/10.3390/ijms22031488
Cabillon, N. A. R., & Lazado, C. C. (2019). Mucosal barrier functions of fish under changing
environmental conditions. Fishes, 4(1), 2. https://doi.org/10.3390/fishes4010002
Carvalho, T. L. A. B., Nascimiento, A. A., Gonçalves, C. F. S, Santos, M. A. J., & Sales A. (2020). Assessing the histological changes in fish gills as environmental biodicators in Paraty and Sepetiba bays in Rio de Janeiro, Brazil. Latin American Journal of Aquatic Research, 48(4), 590-601. http://dx.doi.org/10.3856/vol48-issue4-fulltext-2351
Dang, M., Pittman, K., Sonne, C., Hansson, S., Bach, L., Søndergaard, J., Stride, M., & Nowak, B. (2020). Histological mucous cell quantification and mucosal mapping reveal different
aspects of mucous cell responses in gills and skin of shorthorn sculpins (Myoxocephalus scorpius). Fish & Shellfish Immunology, 100, 334-344. DOI: 10.1016/j.fsi.2020.03.020
De Kinkelin, P., Michel, Ch., & Ghittino, P. (1991). Tratado de las enfermedades de los peces. Editorial Acribia.
Gao, Y., Qiang, L., Zhang, L., Tan, R., Wang, X., & Yu, Y. (2023). Mucosal and humoral responses of javelin goby, Synechogobius hasta, after immersion vaccination using killed Vibrio vulnificus bacterin. Aquaculture International, 31(2), 1097-1113. https://doi.org/10.1007/ s10499-022-01017-z
Haddeland, S., Lazado, C. C., Merkin, G. V., Myre, O. J., Okubamichael, M. A., Pedersen, L., & Pittman, K. (2021). Dynamic morphometrics of mucous cells reveal the minimal impact
of therapeutic doses of peracetic acid on Atlantic salmon gill health. Aquaculture, 534, 736315. https://doi.org/10.1016/j.aquaculture.2020.736315
Han, F. X., Hargreves, J. A., Kingery, W. L., Huggett, D. B., & Schlenk, D. K. (2001). Accumulation,
distribution and toxicity of copper in sediments of catfish ponds receiving periodic
copper sulfate applications. Journal of Environmental Quality, 30(3), 912-919. https://doi. org/10.2134/jeq2001.303912x
Harris, J. E., Watson, A., & Hunt, S. (1973). Histochemical analysis of mucous cells in the epi thelium of brown trout Salmo trutta L. Journal of Fish Biology, 5(3), 345-351.
https://doi.org/10.1111/j.1095-8649.1973.tb04463.x
Kim, S. G., & Kang, J. C. (2004). Effect of dietary copper exposure on accumulation, growth and hematological parameters of the juvenile rockfish, Sebastes schlegeli. Marine
Environmental Research, 58(1), 65-82. https://doi.org/10.1016/j.marenvres.2003.12.004
Khangarot, B. S., & Tripathi, D. M. (1991). Changes in humoral and cell-mediated responses and
in skin and respiratory surfaces of catfish, Saccobranchus fossilis, following copper exposure.
Ecotoxicology and Environmental Safety, 22(3), 291-308. https://doi.org/10.1016/0147- 6513(91)90080-9
Lazado, C. C., Haddeland, S., Timmerhaus, G., Berg, R. S., Merkin, G., Pittman, K., & Pedersen, L. F. (2020).
Morphomolecular alterations in the skin mucosa of Atlantic salmon (Salmo salar) after exposure to peracetic acid-based disinfectant. Aquaculture Reports, 17, 100368. https:// doi.org/10.1016/j.aqrep.2020.100368
Marinović, Z., Miljanović, B., Urbányi, B., & Lujić, J. (2021). Gill histopathology as a biomaker for discriminating seasonal variations in water quality. Applied Sciences, 11(20), 9504.
https://doi.org/10.3390/app11209504
Monteiro, S. M., Fontainhas-Fernandes, A., & Sousa, M. (2010). An immunohistochemical study of
gill epithelium cells in the Nile tilapia, Oreochromis niloticus. Folia Histochemica et Cytobiologica, 48(1), 112-121. https://doi.org/10.2478/v10042-008-0105-5
Moosavi, M. J., & Shamushaki, V-A. J. (2015). Effects of different levels of copper sulfate on growth
and reproductive performances in guppy (P. reticulate). Journal of Aquaculture, Research & Development, 6(2), 1-4. https://www.doi.org/10.4172/2155-9546.1000305
Mowry, R. W. (1956). Alcian blue techniques for the histochemical study of acidic carbohydrates. Journal of Histochemistry and Cytochemistry, 4, 407-408.
Nimet, J., Neves, M. P., Viana, N. P., Amorim, J. P. A., & Delariva, R. L. (2020). Histopathological
alterations in gills of a fish (Astyanax bifasciatus) in neotropical streams: negative effects of riparian forest reduction and presence of pesticides. Environmental Monitoring and
Assessment, 192(58). https://doi.org/10.1007/s10661-019-8030-y
Osório, J., Stiller, K. T., Reiten, B. K., Kolarevic, J., Johansen, L-H., Afonso, F. & Lazado, C. C. (2022).
Intermittent administration of peracetic acid is a mild environmental stressor that elicits mucosal and systemic adaptive responses from Atlantic salmon post-smolts. BMC Zool, 7(1). https://doi.org/10.1186/s40850-021-00100-x
Ostaszewska, T., Chojnacki, M., & Kamaszewski, M. (2016). Histopathological effects of silver and
copper nanoparticles on the epidermis, gills, and liver of Siberian sturgeon. Environmental Science of Pollution Research, 23(2),1621-1633. https://doi.org/10.1007/s11356-015- 5391-9
Palma Leotta, M. E., Caliri, M. N., & Cáceres-Jiménez, A. R. R. (2017). Caracterización histológica
e histoquímica de branquia, hígado y riñón de perca criolla (Percichthys trucha, Valenciennes, (1833) para su uso en biomonitoreo ambiental. Acta Microscopica, 26(1), 32-45
Patología en Acuicultura (2023). Hiperplasia de células mucosas branquiales en Salmón del Atlántico (Salmo salar): Histopatología. Recuperado el 10 de Mayo 2023 de https://bit.ly/41aPaLc.
Pereira, B. F., & Caetano, F. H. (2009). Histochemical technique for the detection of chloride cells in fish. Micron, 40(8), 783-786. https://doi.org/10.1016/j.micron.2009.07.010
Persson, D., Bjørgen, H., Figenschou, A., Hillestad, L., Koppang, E. O., Nødtvedt, A., &
Stormoen, M. (2021). Variation in mucous cell numbers in gills of Atlantic salmon (Salmo salar) presmolt in commercial freshwater farms in Norway. Journal of Fish Diseases, 44(1), 25-32. https://doi.org/10.1111/jfd.13263
Reverter, M., Tapissier-Bontemps, N., Lecchini, D., Banaigs, B., & Sasal, P. (2018). Biological and ecological roles of external fish mucus: a review. Fishes, 3(4), 41.
https://doi.org/10.3390/fishes3040041
Richardson, L. B., Burton, D. T., Block, R. M., & Stavola, A. M. (1983). Lethal and sublethal
exposure and recovery effects of ozone-produced oxidants on adult white perch
(Morone americana Gmelin). Water Research,17(2), 205-213. https://doi org/10.1016/0043-1354 (83)90101-X
Rowland, S. J., Mifsud, Ch., Nixon, M., Read, P., & Landos, M. (2009). Use of formalin and copper to control icththyophthiriosis en the Australian freshwater fish silver perch
(Bidyanus bidyanus Mitchell). Aquaculture Research, 40(1), 44-54. https://doi.or g/10.1111/j.1365-2109.2008.02061.x
Sánchez, J. G., Speare, D. J., & Johnson, G. J. (1997). Morphometric and histochemical assessement of the branquial tissue response of rainbow trout, Onchorhynchus mykiss (Walbaum), associated
with chloramine-T treatment. Journal of Fish Diseases, 20(5), 375-381. https://doi.org/10.1046/ j.1365-2761.1997.00312.x
Smith, S. A., Newman, S. J., Coleman, M. P., & Alex, C. (2018). Characterization of the histologic appearance of normal gill tissue using special staining techniques. Journal of Veterinary Diagnostic Investigacion, 30(5), 688-698. https://doi.org/10.1177/1040638718791819
Tavares-Dias, M., Ferreira, J. S., Affonso, E. G., Ono, E. A., & Martins, M. L. (2011). Toxicity and effects of copper sulfate on parasitic control and hematological response of tambaqui
Colossoma macropomum. Boletim do Instituto de Pesca, 37(4), 355-365.
Tavares-Dias, M. (2021). Toxic, physiological, histomorphological, growth performance and antiparasitic effects of copper sulphate in fish aquaculture. Aquaculture, 535, 736350.
https://doi.org/10.1016/j.aquaculture.2021.736350
van den Heuvel, M. R., Power, M., Richards, J., Mackinnon, M., & Dixon, D. G. (2000).
Disease and gill lesions in yellow perch (Perca flavescens) exposed to oil sands
mining associated waters. Ecotoxicology and Environmental Safety, 46(3), 334-341.
https://doi.org/10.1006/eesa.1999.1912