Pesquisa de T. foetus en bovinos de Tamaulipas, México / Mujica-García et al. (2025)
Pesquisa de Tritrichomonas foetus en bovinos sementales por PCR en Tamaulipas, México
Tritrichomonas foetus screening in breeding cattle by PCR in Tamaulipas, Mexico
Jose Carlos Mujica-García1, Verónica Carvajal-de la Fuente1, Raúl Sauceda-Becerra1,2, Jorge Alva-Pérez1,
José Vázquez-Villanueva1, Hugo Brígido Barrios-García1
*Autor para correspondencia: hbarrios@docentes.uat.edu.mx Fecha de recepción: 17 de enero de 2025
Fecha de aceptación: 29 de enero de 2025 Fecha de publicación: 31 de enero de 2025
1Facultad de Medicina Veterinaria y Zootecnia, Universidad Veracruzana, Veracruz, Ver, México.
2Laboratorio Central Regional del Norte; Guadalupe Nuevo León, México.
![]()
ISSN electrónico: 2992-7501 2(2), 18 - 26 (Ene - Jun 2025)
https://doi.org/10.29059/cvpa.v2i2.31
Resumen
La tricomoniasis bovina es una enfermedad capaz de provocar abortos en bovinos, se caracteriza por presentarse de forma asintomática en los machos y generalmente se transmite por vía venérea. La presencia de tricomoniasis bovina en un hato implica pérdidas económicas por la disminución de la producción de becerros. Considerando que Tamaulipas se caracteriza la por producción de bovinos, es importante evaluar enfermedades abortivas como la tricomoniasis bovina debido a que se ha reportado en estados colindantes como Veracruz al Sur y Texas EUA al Norte. El objetivo de esta investigación fue buscar la presencia de Tritrichomonas foetus en la zona centro de Tamaulipas mediante el uso de la PCR punto final, a partir de muestras de cavidad prepucial de bovinos. Se obtuvieron y procesaron 45 muestras de bovinos de razas cárnicas de Tamaulipas en un periodo de un año; todas las muestras fueron negativas a T. foetus. En este estudio es posible que la alta tecnificación reproductiva en la zona de estudio favorezca la probabilidad de la auencia de este parásito.
Palabras clave: factores de riesgo, PCR, tricomoniasis bovina.
Abstract
Bovine trichomoniasis is a disease capable of causing abortions in cattle. It is characterized by its asymptomatic presentation in males and is generally transmitted by venereal means. The presence of bovine trichomoniasis in a herd implies great economic losses, related to the costs of slaughtering infected males and a decrease in production. Considering that Tamaulipas is characterized by cattle production, it is important to evaluate abortive diseases such as bovine trichomoniasis, whose presence is unknown in this state, but it has been reported in neighboring states (Texas and Veracruz). The objective of this research was to determine the presence of this disease in the central area of Tamaulipas by using endpoint PCR, from samples of the preputial cavity of cattle. The samples consisted in 45 samples of beef breeds from Tamaulipas processed in a year period, all of them were negative for Tritrichomonas foetus. It is possible that the high level of reproductive technology in the area increases the probability of the presence of this parasite.
Keywords: risk factors, PCR, bovine tricomonosis.
Introducción
Las enfermedades venéreas en bovinos tienen gran impacto económico debido a que inducen abortos e infertilidad en la hembra, lo que resulta en pérdidas económicas para los productores al no cumplir con el objetivo de un ternero por hembra al año (Rojo-Montejo et al., 2014). De las enfermedades venéreas que afectan a los bovinos se encuentran la tricomoniasis, una enfermedad parasitaria que, a diferencia del resto de enfermedades venéreas, se caracteriza por presentarse de manera asintomática en los machos. Esto facilita la transmisión del parásito a las hembras a través de la cópula durante el empadre, o a través del semen contaminado al momento de la inseminación artificial y recientemente se ha reportado que la transmisión en hembras también puede ser vía oro fecal (Martínez et al., 2023).
Debido a su diagnóstico tardío, la principal forma de controlar esta enfermedad es mediante la medicina preventiva, aunque, el diagnóstico oportuno también permitirá evitar pérdidas económicas (Michi et al., 2016).
Para identificar la presencia de la tricomoniasis se pueden emplear diversas técnicas de diagnóstico, como los son: la identificación etiológica mediante técnicas microscópicas de muestras clínicas de exudados prepuciales en toros, la identificación de anticuerpos mediante la serología y la identificación genética mediante técnicas moleculares (OIE, 2018). De las técnicas de diagnóstico disponibles, las que presentan mayores ventajas son las técnicas moleculares debido a su sensibilidad y especificidad. La reacción en cadena de la polimerasa es ideal para llevar a cabo el diagnóstico y determinar la presencia de la tricomoniasis debido a que se basa en la amplificación de zonas genéticas 100% específicas del agente en cuestión y presenta una gran confiabilidad, así como también, reducción de tiempo para obtener los resultados comparada con las otras técnicas que dependen de factores como la experiencia del analista y posibles falsos positivos (Riegler, 2023).
Actualmente no se cuenta con información documentada sobre la frecuencia de Tritrichomonas foetus en Tamaulipas, aunque se tiene referencia de su presencia en dos estados colindantes: Veracruz al sur (Villareal-Ruiz, 2020) y Texas al norte (Szonyi et al., 2012).
MATERIALES Y MÉTODOS
Área de estudio
Se realizó un muestreo por conveniencia, no probabilístico, en sementales bovinos mayores de dos años y de diferentes razas en Unidades de Producción Pecuaria (UPP) ubicadas en la región centro de Tamaulipas, México (CEAT, 2023). La duración del muestreo fue de un año de agosto del 2023 a agosto del 2024.
Material biológico
Para la colecta de muestra se emplearon dos métodos de recolección en cavidad prepucial. Uno fue el método de raspado prepucial, el cual consiste en introducir un raspador metálico dentro del prepucio del animal, preservando debidamente el bienestar animal, hasta alcanzar la zona del fórnix, donde se lleva a cabo un raspado vigoroso de atrás hacia adelante sobre el epitelio prepucial y del fórnix, el cual se repite de 30 a 45 veces. Por último, se colecta el material introduciendo la cabeza del raspador con el material en un tubo estéril de 50 ml con solución salina estéril, donde se realiza un enjuague para retirar el material colectado (Villalba & Villalba, 2010; OIE, 2018). El otro método fue el lavado prepucial, el cual consiste en introducir 50 ml de solución salina estéril mediante cánula, una vez introducida la solución se cierra manualmente el ostium y se lleva cabo un masaje enérgico enfocado en toda la zona prepucial por aproximadamente 4 minutos, una vez terminado el masaje se recolecta la solución por escurrimiento en un tubo de 50 ml estéril (Yao, 2013). El material colectado se mantuvo en congelación hasta su procesamiento. El resguardo y procesamiento de las muestras se llevó a cabo en el área de biología molecular del laboratorio de diagnóstico de la FMVZ-UAT.
Purificación de ADN
Se obtuvieron las fases solidas de las muestras mediante centrifugación en condiciones de 3,500 rpm x 5 min. Posteriormente se pasaron a tubos de 1.5 ml y fueron tratadas con el equipo comercial DNeasy Sangre y Tejido (QIAGEN® Alemania), siguiendo las instrucciones del fabricante. El protocolo se basa en obtener el ADN presente en la muestra mediante el empleo de distintos compuestos orgánicos con capacidad de disolver los componentes celulares a excepción del ADN, este se separa de los otros compuestos mediante centrifugación (3500 rpm durante 10 minutos). Una vez obtenido el ADN genómico de cada muestra, se mantuvieron en congelación (-20˚C) hasta su uso posterior.
Evaluación del ADN
Una vez finalizado el procedimiento de purificación de los ácidos nucléicos, se utilizó una alícuota de 6 µl de la extracción de ADN mezclada con 2.5 µl de tampón de carga (5X Loading buffer dye Bioline®), para confirmar el proceso de extracción del ADN. Esto se realizó a través de electroforesis en geles de agarosa (Bioline®) al 1.5%, ejecutando un campo electroforético a 80 Voltios (V) durante 30 min (Sambrook, 2001).
Reacción en cadena de la polimerasa (PCR)
Para la amplificación de T. foetus se emplearon los cebadores TRF-3 (5'-CGGGTCTTCCTATATGAGACAGAACC-3') y TRF-4 (5'-CCTGCCGTTGGATCAGTTTCGTTAA-3'), los cuales amplifican una región de 347 pares de bases del gen 5.8S RNA de T. foetus, (Felleisen et al., 1997). Como testigo positivo para la prueba de PCR se empleó la cepa de referencia Tritrichomonas foetus (Riedmuller) Wenrich and Emerson (ATCC 50152). Cada PCR consistió en una solución de 3 µL de tampón Taq polimerasa 10×, 2.5 µL de 50 mM MgCl2, 1.0 mM de dNTP, 2 U de Taq ADN polimerasa, 10 µM de cada cebador, 10 µL de ADN genómico y agua libre de nucleasas hasta un volumen final de 30 µl (Botelho et al., 2018). Las condiciones de ciclado de PCR para T. foetus fueron: desnaturalización inicial 15 segundos a 95 °C, seguido de 35 ciclos de desnaturalización durante 30 segundos a 94 °C, alineación 30 segundos a 60 °C, extensión por 30 segundos a 72 °C y una extensión final de 7 minutos a 72 °C (Botelho et al., 2018).
Electroforesis y fotodocumentación
Los productos de PCR se evaluaron por electroforesis utilizando geles de agarosa al 2%, en amortiguador Tris-Acetato-EDTA (TAE1X Bio-Rad, EE. UU.). Las condiciones electroforéticas fueron: 85 V constantes, miliamperios (mAh) variables por 90 min. Posteriormente los geles fueron teñidos con bromuro de etidio durante 30 min (Promega, EE. UU.) (0.1 µg/mL) (Sambrook, 2001). Los geles teñidos se observaron y fotodocumentarón en un transiluminador E-Gel imager system (Life Technologies Corporation).
Recolección de datos
Se obtuvieron los datos de raza, edad y municipio, utilizando a las bases de datos de las unidades de producción, esto mediante la toma de cada número de identificación interna que poseía cada animal evaluado.
RESULTADOS
Muestreo
En total se obtuvieron 45 muestras; 29 muestras obtenidas de lavado prepucial y 16 de raspado prepucial de bovinos. El rango de edad fue de 3 a 12 años con un promedio de edad de 6.2 años y las razas fueron: Angus negro, Angus rojo, Brahman, Brangus negro, Brangus rojo, Beef Master, Charbray, Charolais, Hereford, Simbra, Simmental. En la tabla 1 se indica el número de animales muestreados por municipio en Tamaulipas.
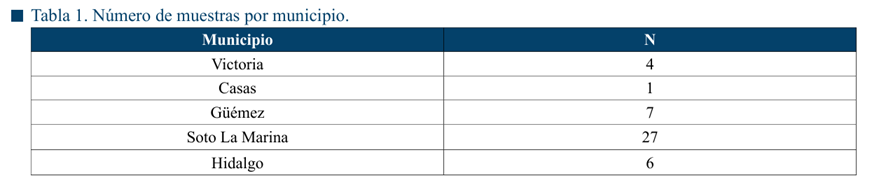
Se estableció el protocolo para desarrollar la PCR para la identificación de T. foetus con la cepa de referencia Tritrichomonas foetus (Riedmuller) Wenrich and Emerson (ATCC 50152). El tamaño del producto de amplificación para el control positivo fue de 347 pb, confirmando la presencia de T. foetus en la muestra, como se ve en la figura Figura 1.
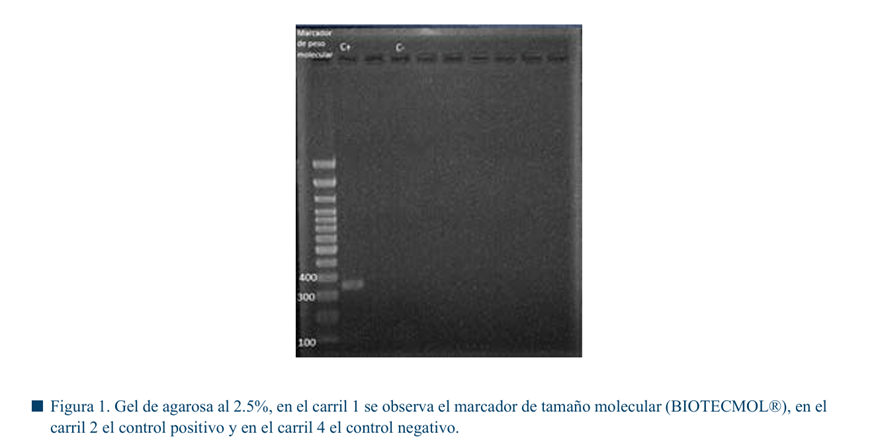
Extracción y purificación de ADN
Se obtuvo ADN genómico de cada muestra, el cual se confirmó mediante electroforesis en gel, en la figura 2 se observa ejemplo de una extracción. Las concentraciones promedio de ADN obtenidas de las diferentes técnicas de muestreo fueron las siguientes: para raspado prepucial 75.52 ng/μL y para lavado prepucial 87.61 ng/μL.
PCR
Los resultados en las 45 muestras analizadas fueron negativos para la presencia T. foetus.
DISCUSIÓN
La PCR punto final como método de identificación para T. foetus ha sido anteriormente utilizada por diversos autores (Felleisen et al., 1997; Martínez et al., 2023; Silveira et al., 2020), si bien el cultivo microbiológico es la técnica más empleada debido a la facilidad que puede ser realizarla (OIE, 2018), los resultados se obtienen hasta una semana después, a diferencia de la PCR, en donde se pueden tener los resultados en un lapso de un día (Felleisen et al., 1997). Aunque varios autores reportan sensibilidades altas para el cultivo comercial InPounch (Kittel et al., 1998;), esta se puede altera debido a que existe la posibilidad de contaminación o por factores de manejo, además la sensibilidad en otros medios de cultivo es muy variable (OIE, 2018). Silveira et al. (2020) reportan, que el medio de cultivo o de transporte utilizados en el muestreo, así como los cambios de temperatura y la agitación son factores que pueden disminuir la eficacia del crecimiento de T. foetus , aunado a esto, al momento de identificar a T. foetus en el cultivo este podría ser confundido con otros tricomoniados considerados como saprófitos (Riegler, 2023) dando falsos positivos, como el caso de Dąbrowska et al. (2020) quienes encontraron crecimientos en muestras en cultivo, sin embargo en PCR no obtuvieron ningún positivo de las muestras que mostraron crecimiento en cultivo. En contraste la PCR al ser una técnica de identificación exclusivamente genética tiene menor probabilidad de mostrar falsos positivos, si bien se ha reportado que los iniciadores TRF3 Y TRF3 también amplifican ante otras especies de Tritrichomonas, estas especies solo se han reportado en el tracto digestivo de cerdos (Felleisen et al. 1997). Es sabido que para un óptimo diagnóstico de T. foetus, lo ideal será un cultivo con alta sensibilidad, como el inPouch, aunado a un buen manejo y trasporte, complementándolo con PCR, así como también, repetir los muestreos en los mismos animales para descartar por completo o confirmar el diagnostico (OIE, 2018). Sin embargo, ya se ha demostrado que con el solo uso de que PCR directo de la muestra clínica es posible detectar la presencia del protozoario de transmisión venérea.
Las técnicas diagnósticas utilizadas en los distintos estudios sobre T. foetus son variadas, suponiendo que los métodos moleculares presentan mayores sensibilidades y especificidades (OIE, 2018), en las investigaciones revisadas en esta discusión, se puede inferir que el uso únicamente de cultivo no es infalible debido a los falsos positivos que ya se han mencionado, lo idóneo es utilizar en conjunto ambas técnicas.
En este estudio en el que se evaluaron sementales de razas productoras de carne, no se detectó la presencia del parásito T. foetus, resultado que coincide con los resultados de Da Rocha et al. (2009) en Brasil donde se evaluaron 39 muestras de toros, siendo 30 de carne y 9 de leche en donde no se encontró la presencia del parásito. En otro estudio también realizado en Brasil (Ribeiro, 2020), no se encontró la presencia de T. foetus, después de evaluar 27 muestras de sementales bovinos; al igual que al resultado de Torres y Niño en 2019, quienes evaluaron 37 bovinos en Colombia, en su mayoría razas cebú en donde el resultado de la detección para de T. foetus fue negativo. De igual forma Dąbrowska et al. (2020) en Polonia, donde analizaron 180 muestras de lavados y raspados encontraron que el 100% de animales fue negativo a T. foetus. Los investigadores no reportaron la raza, pero asocian su resultado a la alta tecnificación en la reproducción en el país; el resultado también es similar a lo reportado en Uruguay por Da Silva et al. (2020), quienes únicamente encontraron un espécimen positivo de 189 toros de carne que analizaron. Así mismo Montañes et al. (2023) en España analizaron 216 toros para determinar la prevalencia de T. foetus y solo encontraron un 5% de muestras positivas, coincidiendo la baja prevalencia con el 54% de sus muestras procedentes de bovinos de la raza limusin, raza que destaca por su producción de carne. Por lo anterior, es posible que las razas cárnicas presenten una resistencia o menor predisposición a infectarse o portar a T. foetus , siendo necesario, en un futuro, investigar a nivel genético si existe algún factor que ocasione esta resistencia, como puede ser genes de resistencia a enfermedades; también se recomienda ampliar el estudio en ganado lechero en la región, dado que en investigaciones donde se confirma la presencia de T. foetus ha coincidido en la evaluación de razas bovinas lecheras (Filho et al., 2018; Silveira et al., 2020), Silveira et al. (2020) consideraron que T. foetus está presente con mayor frecuencia en ganado lechero que de carne. Sin embargo, el tipo de explotación extensiva es el factor más determinante para que esté presente este parásito, como lo reportaron Mendoza-Ibarra et al. (2012). Ellos observaron altas prevalencias en ganado de carne, pero bajo un sistema extensivo.
La presencia de T. foetus en México ha sido reportada por Villareal-Ruiz (2020), en el estado de Veracruz, quien reportó una frecuencia de 28.21% en 39 muestras analizas, de las cuales 9 fueron positivas en hembras y 2 en machos. El estudio no muestra las características raciales de los bovinos. En el estado de Sonora también ha sido reportada según, Aragón-López (2023), sin embargo, no reporta la cantidad de muestras ni las razas evaluadas, solo se menciona que utilizaron animales con antecedentes de abortos. La información en México aún es escasa y la falta de información sobre las razas o el número de muestras no permite comparar resultados, haciendo necesario más investigaciones sobre la Tricomoniasis bovina en el país. A pesar de la cercanía de Tamaulipas con Veracruz (México) y Texas (E.U.A.), donde se ha reportado la presencia de T. foetus, en este estudio no se detectó la presencia de T. foetus, esto podría deberse al número de muestras trabajadas, factor que podría influir para detectar del patógeno.
CONCLUSIONES
En este estudio preliminar no se detectó la presencia de T. foetus en sementales muestreados en Tamaulipas. La alta tecnificación en los procesos reproductivos tales como como la inseminación artificial, fertilización in vitro, uso de sementales de registro, además del número de animales analizados en este estudio, son factores que influyen en la disminución de la probabilidad de que esta enfermedad se pueda presentar en un hato; sin embargo, es necesario continuar con más monitoreos aumentando el tamaño de muestra y en diferentes regiones del estado.
REFERENCIAS
Aragón-López, C. E., Flores-Encinas, L. A., Pérez-Hernández, N. A., Rojas-Arzaluz M., & Leyva Corona J. C. (2023). Desarrollo de un ensayo de amplificación isotérmica mediada por bucles con detección visual por colorimetría (cr-LAMP): una tecnología eficiente para el diagnóstico molecular a Tritrichomonas foetus en toros. https://www.ganaderia.com/destacado/desarrollo-de-un-ensayo-de-amplificacion-isotermica-mediada-por-bucles-con-deteccion-visual-por-colorimetria-cr-lamp-una-tecnologia-eficiente-para-el-diagnostico-molecular-a-tritrichomonas-foetus-en-toros
Botelho, M. P. A., Hirsch, C., Lage, A. P., Rocha, C. M. B. M. da, Dorneles, E. M. S., Cardoso, P. G., & da Costa, G. M. (2018). Prevalence of Tritrichomonas foetus and Campylobacter fetus subsp. venerealis among bulls slaughtered in the state of Minas Gerais, Brazil. Semina: Ciências Agrárias, 39(5), 2039. https://doi.org/10.5433/1679-0359.2018v39n5p2039
da Rocha, F. S., de Jesus, V. L. T., Torres, H. M., Gomes, M. J. P., de Figueiredo, M. J., do Nascimento, E. R., & de Aquino, M. H. C. (2009). Campylobacter fetus and Tritrichomonas foetus investigation in prepucial mucous of bulls from Medio Paraiba/RJ region, Brazil/Investigacao de Campylobacter fetus e Tritrichomonas foetus na mucosa prepucial de touros da regiao do Medio Paraiba, RJ. Ciencia Rural, 39(5), 1586-1590.
Da Silva, C., Fraga, M., Monesiglio, C., & Delpiazzo, R. (2020). Detection of Tritrichomonas foetus by PCR in preputial smegma of bulls in Uruguay. Veterinaria (Montevideo), 56(213), 17. https://doi.org/10.29155/VET.56.213.7
Dąbrowska, J., Karamon, J., Kochanowski, M., Sroka, J., Skrzypek, K., Zdybel, J., Różycki, M., Jabłoński, A., & Cencek, T. (2020). Tritrichomonas foetus: A study of prevalence in animal hosts in Poland. Pathogens, 9(3). https://doi.org/10.3390/pathogens9030203
Felleisen, R. S. (1997). Comparative genetic analysis of tritrichomonadid protozoa by the random amplified polymorphic DNA technique. Parasitology Research, 84, 153-156. https://link.springer.com/content/pdf/10.1007/s004360050374
Filho, R. B. D. O., Malta, K. C., Borges, J. D. M., De Oliveira, P. R. F., Filho, G. J. D. S., Nascimento, G. G., Mota, R. A., & Júnior, J. W. P. (2018). Prevalence and risk factors associated with Tritrichomonas foetus infection in cattle in the state of Paraíba, Brazil. Acta Parasitologica, 63(2), 346-353. https://doi.org/10.1515/ap-2018-0039
Kittel, D. R., Campero, C., Van Hoosear, K. A., Rhyan, J. C., & BonDurant, R. H. (1998). Comparison of diagnostic methods for detection of active infection with Tritrichomonas foetus in beef heifers. Journal of the American Veterinary Medical Association, 213(4), 519-522.
Mardones, F. O., Perez, A. M., Martínez, A., & Carpenter, T. E. (2008). Risk factors associated with Tritrichomonas foetus infection in beef herds in the Province of Buenos Aires, Argentina. Veterinary Parasitology, 153(3-4), 231-237. https://doi.org/10.1016/j.vetpar.2008.01.038
Martínez, C. I., Iriarte, L. S., Salas, N., Alonso, A. M., Pruzzo, C. I., dos Santos Melo, T., Pereira-Neves, A., de Miguel, N., & Coceres, V. M. (2023). Prolonged survival of venereal Tritrichomonas foetus parasite in the gastrointestinal tract, bovine fecal extract, and water. Microbiology Spectrum, 11(6). https://doi.org/10.1128/spectrum.00429-23
Mendoza-Ibarra, J. A., Pedraza-Díaz, S., García-Peña, F. J., Rojo-Montejo, S., Ruiz-Santa-Quiteria, J. A., San Miguel-Ibáñez, E., Navarro-Lozano, V., Ortega-Mora, L. M., Osoro, K., & Collantes-Fernandez, E. (2012). High prevalence of Tritrichomonas foetus infection in Asturiana de la Montaña beef cattle kept in extensive conditions in Northern Spain. Veterinary Journal, 193(1), 146-151. https://doi.org/10.1016/j.tvjl.2011.09.020
Michi, A. N., Favetto, P. H., Kastelic, J., & Cobo, E. R. (2016). A review of sexually transmitted bovine trichomoniasis and campylobacteriosis affecting cattle reproductive health. Theriogenology, 85(5), 781-791. https://doi.org/10.1016/j.theriogenology.2015.10.037
Molina, L. L., Angón, E., García, A., Caballero-Villalobos, J., Giorgis, A. O., Moralejo, R. H., & Perea, J. (2018). A retrospective epidemiological analysis of shared risk factors for bovine trichomoniasis and bovine genital campylobacteriosis in La Pampa province (Argentina). Preventive Veterinary Medicine, 161, 109-114. https://doi.org/10.1016/j.prevetmed.2018.10.022
Montañés, M., García-García, J. J., Benito, A., & Bodas, R. (2022). Calidad seminal e incidencia de tricomonosis y campilobacteriosis en sementales de vacuno de carne de Castilla y León. Información Técnica Económica Agraria, 119(1), 54-61. https://doi.org/10.12706/itea.2022.006
OIE. (2018). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (2018). Chapter2.4.16. Trichomonosis. World Organization for Animal Health. p. 1-15. Recuperado 01/02/2023: http://www.oie.int/fileadmin/Home/fr/Health_standards/tahm/2.04.16_TRICHOMONOSIS.pdf.
Okafor, C. C., Strickland, L. G., Jones, B. M., Kania, S., Anderson, D. E., & Whitlock, B. K. (2017). Prevalence of Tritrichomonas foetus in Tennessee bulls. Veterinary Parasitology, 243, 169-175. https://doi.org/10.1016/j.vetpar.2017.06.024
Ondrak, J. D., Keen, J., Rupp, G., Kennedy, J., McVey, D., Baker, W. (2010). Tritrichomonas foetus Prevention and Control in Cattle. Veterinary Clinics of North America: Food Animal Practice, 32(2), 411-423. https://doi.org/10.1016/j.cvfa.2016.01.010
Riegler, L. (2016). Aplicación de la Reacción en Cadena de la Polimerasa (PCR) para el diagnóstico diferencial de Tritrichomonas foetus en cultivos positivos de parásitos de la familia Trichomonadidos [Tesis de especialidad]. Universidad Nacional de la Plata.
Rojo-Montejo, S., Sanchez Sanchez, R., Ortega Mora, L. M., Osoro Otaduy, K., & Collantes-Fernandez, E. (2014). Prevalencia de la tricomonosis bovina en las razas Asturiana de la Montaña y Asturiana. http://www.serida.org/publicacionesdetalle.php?id=5723
Sambrook, J., & Russel, D. W. (2001). Molecular Cloning: A Laboratory Manual (3rd ed., Vol. 1). Cold Spring Harbor Laboratory Press.
Silveira, C. da S., Fraga, M., Monesiglio, C., Delpiazzo, R., Macías-Rioseco, M., Giannitti, F., Riet-Correa, F. (2020). Detección de Tritrichomonas foetus por PCR en esmegma prepucial de toros en Uruguay. Veterinaria (Montevideo), 56(213). https://doi.org/10.29155/vet.56.213.7
Szonyi, B., Srinath, I., Schwartz, A., Clavijo, A., Ivanek, R. (2012). Spatio-temporal epidemiology of Tritrichomonas foetus infection in Texas bulls based on state-wide diagnostic laboratory data. Veterinary Parasitology, 186(3-4), 450-455. https://doi.org/10.1016/j.vetpar.2011.11.075
Villalba, I., & Villalba, J. S. (2010). Raspaje prepucial de toros y colocación de tabla para protección del profesional. Sitio Argentino de Producción Animal. Repositorio Digital de Acceso Abierto. www.produccion-animal.com.ar
Villareal-Ruiz, A. A. (2020). Asociación de Tricomoniasis felina y bovina en unidades de producción pecuaria en la zona central del Estado de Veracruz [Tesis de maestría, Universidad Veracruzana]. www.uv.mx/veracruz/fmvz