Enfermedades por Clostridium perfringens en animales domésticos / Ibarra-Zazueta et al. (2024)
Hallazgos patológicos de la infección por Clostridium perfringens en animales domésticos
Pathology hallmarks of Clostridium perfringens infection in domestic animals
Cristina Ibarra-Zazueta1, Gilberto Ballesteros-Rodea2,
Gerardo Noé Rosales-Martínez3, Luz Yosahandy Peña-Avelino3, Jorge Alva-Pérez3*
*Autor para correspondencia: jalva@docentes.uat.edu.mx Fecha de recepción: 24 de junio de 2024
Fecha de aceptación: 31 de julio de 2024 Fecha de publicación: 8 de agosto de 2024
1Departamento de Agricultura y Ganadería, Universidad de Sonora, Hermosillo Sonora, México.
2:Facultad de Agronomía y Veterinaria. Universidad Autónoma de San Luis Potosí. San Luis Potosí, México
3Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Tamaulipas, Ciudad Victoria, Tamaulipas. México.
![]()
Resumen
Clostridium perfringens es una bacteria anaerobia, Gram positiva en forma de bastón, que produce esporas y es aerotolerante. Este agente puede habitar en suelo y en la microbiota intestinal de animales adultos sanos, donde se favorece su diseminación y por ello las infecciones por Clostridium perfringens son frecuentes en animales de interés doméstico y en humanos. Es el principal causante de enterotoxemia, aunque puede no ser el principal agente etiológico. La producción de toxinas, clasificadas del tipo A al G, y la toxemia subsecuente se presentan en animales jóvenes y adultos, en los que puede provocar hasta el 100% de mortalidad. Dentro de los hallazgos patológicos se observan diversos grados de enteritis (íleon y colon) así como lesiones en encéfalo y mesencéfalo, aparato urinario y músculo por el daño endotelial grave. Es importante conocer los hallazgos patológicos de los diferentes toxinotipos asociados a esta bacteria con el objetivo de reconocer esta enfermedad y poder controlar su aparición.
Palabras clave: Clostridium perfringens, diarrea, enteritis, enteroxemia, toxinas.}
Abstract
Clostridium perfringens infections are frequent in domestic animals and humans. It is an anaerobic, Gram-positive, rod-shaped, spore-producing, aerotolerant bacterium. This agent can inhabit soil as well as the intestinal microbiota of healthy adult animals, which favors dissemination in the environment. It is the main cause of enterotoxemia, although it is not the main actor in the definitive diagnosis. The production of toxins, classified from type A to G, and the subsequent toxemia occur in young and adult animals, causing up to 100% mortality. Pathological findings include various degrees of enteritis (ileum and colon), diarrhea and lesions in the brain and midbrain, urinary system and muscle due to severe endothelial damage. It is important to know the pathological findings of the different toxinotypes associated with this bacterium in order to learn about this disease and be able to control its appearance.
Keywords: Clostridium perfringens, diarrhea, enteritis, enterotoxemia, toxins.
Introducción
Clostridium perfringens es una bacteria Gram positiva, en forma de bastón, anaerobia y esporulante (Garcia et al., 2012). Es uno de los patógenos con mayor distribución, debido a que puede ser aislado del suelo y agua residual, además de formar parte de la microbiota intestinal de animales y humanos (Morris & Fernández-Miyakawa, 2009; Hassan et al., 2015). La bacteria crece en medios ricos en carbohidratos en los que a partir de la fermentación produce hidrogeno y dióxido de carbono, lo que le ayuda a mantener el ambiente anaeróbico (Morris & Fernández-Miyakawa, 2009). A diferencia de otras bacterias anaerobias obligadas, C. perfringens tiene una alta resistencia al oxígeno y se puede mantener viable en su presencia (Grenda et al., 2023). Esta bacteria produce infección intestinal que se manifiesta en tres entidades patológicas como enteritis, enterocolitis y/o enterotoxemia (Jayaraman et al., 2013; Shrestha et al., 2018; Grenda et al., 2023). Las enterotoxemias producidas por Clostridium perfringens se encuentra en una gran variedad de animales domésticos y el hombre (Redondo, 2015; Uzal et al., 2018). En la enterotoxemia la producción de toxinas (Tabla 1 y 2) se presentan a nivel del íleon, principalmente (Layana et al., 2006; Navarro et al., 2018) y en menor medida en el colon, con su subsecuente absorción.

El efecto de las toxinas se puede observar, tanto de manera local como sistémica (Uzal, 2010). Por otro lado, la enteritis es causada por la acción de estas toxinas (Cooper et al., 2013).
En la infección por Clostridium perfringens la mayoría de las manifestaciones clínicas en mamíferos son debidas a las entidades patológicas antes descritas. La manifestación clínica de la infección incluye pérdida de apetito, letargo, diarrea, cólicos, deshidratación y en casos severos la muerte en mamíferos (Uzal & Songer, 2008). En aves la forma clínica produce plumas erizadas, gases fétidos y diarrea (Muneeb et al., 2024).
Es importante mencionar que C. perfringens no es la única especie de Clostridium involucrado en enterotoxemia, otras especies como C. sordelli, C. difficile, C. fallax y C. barallii también pueden estar involucradas en una patología similar producida por Clostridium perfringens (Cooper et al., 2013; Redondo, 2015; Uzal et al., 2018).
Las principales lesiones se observan en el colon e intestino delgado, esto depende de las toxinas secretadas (Ali Nasir et al., 2015; Zaragoza et al., 2019). La toxemia se manifiesta principalmente en animales jóvenes, manifestándose con una muerte súbita (Eroksuz et al., 2018).
Los diagnósticos de los problemas entéricos (enteritis, enterocolitis y enterotoxemia) asociados a la infección por Clostridium spp, debe incluir tanto la historia clínica, la valoración de la semiótica y el análisis de las lesiones en los diferentes tejidos. La identificación molecular puede ser de gran utilidad para establecer el diagnóstico final (Abd El-Hack et al., 2022).
Producción de toxinas
Para entender la fisiopatología de C. perfringens, así como su acción (sistémica o local) en diferentes hospedadores, se ha clasificado esta bacteria en siete diferentes tipos (toxinotipos), basado en su capacidad para producir y secretar toxinas (Tabla 1) García et al., 2012; Uzal et al., 2018). Esta bacteria es capaz de producir 20 diferentes tipos de toxinas muchas de ellas se encuentran codificados en ADN plasmídico (Kiu & Hall, 2018; Grenda et al., 2023). Las acciones de las diferentes toxinas son variadas, en su mayoría producen muerte celular (Tabla 2).
Las principales toxinas que producen daño tisular y mortalidad en animales domésticos son la toxina alfa (CPA), toxina beta (CPB), toxina épsilon (ETX), toxina iota (ITX), enterotoxina (CPE) y toxina tipo B productora de enteritis necrótica (NetB) (Eroksuz et al., 2018; Navarro et al., 2018;Uzal et al., 2018). La patogenia de cada toxinotipo depende del repertorio de toxinas que producen (Abd El-Hack et al., 2022; Mohiuddin et al., 2023). Mientras que algunas toxinas provocan daño únicamente a nivel intestinal (como ITX), algunas otras son absorbidas por el torrente sanguíneo y ocasionan lesiones en diferentes tejidos. Es importante mencionar que en este artículo de revisión se describirá el grupo de toxinas más significativas de cada toxinotipo (principales factores de virulencia). Sin embargo, existen un gran repertorio de toxinas y proteínas diferentes (codificadas en plásmidos de diferentes tipos, o a nivel cromosomal) que coadyuvan al daño tisular y por ende a la sobrevivencia de C. perfringens (Tabla 2). Esta bacteria cuenta con colagenasas, sialidasas, hialuronidasas, proteínas de unión al colágeno, perfringolisina O, entre otras proteínas que pueden o no actuar de manera sinérgica con las toxinas antes descritas, contribuyendo así con la patogenia (Lee & Lillehoj, 2021).
Enfermedades producidas y hospedadores
Enterotoxemia por C. perfringens A
C. perfringens A (productora de toxina CPA) ha tenido poca relación con enterotoxemia en rumiantes, caninos y cerdos. Sin embargo, se ha determinado que CPA está involucrada en gangrena gaseosa muscular (Grenda et al., 2023). De hecho, en seres humanos la toxina CPA es hemolítica y dermonecrótica, y es la principal responsable de la mionecrosis clostridial que puede producir edema subcutáneo, enfisema, falla multiorgánica e incluso la muerte (Navarro et al., 2018). Esta toxina se compone de un dominio amino-catalítico y el dominio carboxilo de membrana, que permite la unión con esfingolípidos, principalmente fosfatidilcolina y esfingomielina, produciendo hidrólisis de estas. Por otro lado, CPA también puede unirse a gangliósidos de membrana celular. El efecto es traducido como desestabilización de membrana, lo que produce lisis celular y necrosis (Navarro et al., 2018).
La enterotoxemia por CPA es la principal etiología de la enfermedad del cordero amarillo, una enterotoxemia letal en corderos (Uzal & Songer, 2008). Además de C. perfringens A, todos los toxinotipos pueden producir CPA (además de compartir las toxinas a, b2 y q, Tabla 1), por lo que cualquier toxinotipo tendrá la capacidad de producir la enfermedad del cordero amarillo. La ictericia, anemia y hemoglobinuria, como principales signos clínicos, son observados en estos animales (Uzal et al., 2022). Cuando estos signos clínicos son evidentes, la supervivencia de los corderos no sobrepasa las 12 horas. En corderos muertos, a veces, puede observarse únicamente ictericia. En lesiones encontradas a la necropsia se puede observar hígado friable y pálido, esplenomegalia y nefrosis (Uzal & Songer, 2008). En algunos casos, puede haber congestión pulmonar y edema. En caninos, se ha relacionado C. perfringens A con la presencia de gastroenteritis hemorrágica mientras que, en potros, con enterocolitis necrotizante (Redondo, 2015).
Enterotoxemia por C. perfringens B
El toxinotipo B de C. perfringens produce tres toxinas principales: CPA, CPB y ETX (Wan et al., 2023). El efecto de CPA se ha discutido con anterioridad. Por otro lado, CPB y ETX se han identificado como toxinas potentes con diversos efectos. La toxina CPB de Clostridium perfringens actúa formando poros en las membranas celulares de las células diana (principalmente células endoteliales, por oligomerización), lo que lleva a un desequilibrio osmótico y lisis celular. Se ha observado que CPB puede unirse al receptor celular P2X7-asociado a ATP. A nivel tisular, la disrupción de las células endoteliales de la submucosa produce retracción de la mucosa intestinal. Este mecanismo es responsable del daño tisular severo observado en enfermedades como la enteritis necrótica y la enterotoxemia en animales (Navarro et al., 2018). La toxina CPB es sensible a la digestión e inactivación por tripsina, enzima que se encuentra en concentraciones bajas en neonatos; esto favorece que en corderos y cabritos se manifieste la enfermedad conocida como disentería del cordero, enfermedad que se manifiesta como enteritis hemorrágica (Redondo, 2015). Por otro lado, la toxina ETX es secretada como protoxina, y su acción se potencializa hasta 1000 veces cuando sufre proteólisis a nivel intestinal (Bokori-Brown et al., 2011). La toxemia por ETX se manifiesta en animales adultos hospedadores con una concentración normal de tripsina, en comparación con hospedadores neonatos (Wan et al., 2023). La toxina es conocida por ser una citotoxina heptamérica formadora de poros en la membrana celular, que, aunque es producida a nivel intestinal, su absorción sanguínea permite que tenga efectos sistémicos, principalmente en riñón, pulmones y sistema nervioso central. Aunque no se conoce completamente el mecanismo, se ha determinado que ETX se absorbe a nivel intestinal debido a los cambios degenerativos de la lámina propia del intestino. No se ha dilucidado por completo los receptores celulares específicos para ETX, sin embargo, se reconoce que la enzima de membrana esfingomielinasa neutral (nSMase), así como la proteína de mielina y de linfocitos (MAL) están involucradas en la formación de la oligomerización de la toxina que produce poros celulares. El efecto celular es observado como hinchazón celular, vacuolización y finalmente necrosis (Navarro et al, 2018). Se ha observado que la toxina daña directamente las células endoteliales de la barrera hematoencefálica, produciendo edema cerebral, aumento de la presión intracraneal y daño directo a las neuronas y oligodendrocitos (Navarro et al., 2018; Finnie & Uzal, 2024).
C. perfringens B provoca en borregos adultos una enteritis que tiende a la cronicidad. Se ha determinado que ETX se absorbe en sangre y es responsable de la aparición de signos neurológicos (Freedman et al., 2016). En contraste, CPB es responsable de los signos clínicos observados en animales jóvenes (Wan et al., 2023). Los signos clínicos de la disentería del cordero incluyen dolor agudo abdominal y diarrea sanguinolenta, sin embargo, puede haber muerte súbita sin signos clínicos. En cabritos los signos pueden ser similares. En animales mayores a los 14 días es más probable observar signos clínicos tales como dolor abdominal, timpanismo, anorexia, depresión e incapacidad para moverse (Redondo, 2015). El mecanismo de acción de la toxina CPA ha sido descrita con anterioridad. C. perfringens B produce enteritis necrotizante en becerros, lechones y potros, aunque no es común. Entre las lesiones detectadas a la necropsia se encuentran una enteritis necrotizante y hemorrágica, que predomina principalmente en el íleon. Se han realizado evaluaciones en otras especies (ratones) y las lesiones ocurren en el colon y ciego (Losada-Eaton & Fernandez-Miyakawa, 2010). En casos agudos se ha observado hiperemia intestinal y mesentérica. En el contenido intestinal se pueden encontrar restos sanguinolentos mezclado con fibrina (enteritis fibronecrótica extensiva, difusa o segmental). También es observable un edema serosanguinolento que se puede llegar a extender en la cavidad torácica (Uzal & Songer, 2008). En pollos de engorda, los signos incluyen daño en intestino y la presencia de plumas erizadas (Mohiuddin et al., 2023).
En rumiantes adultos con enterotoxemia crónica se observa encefalomalacia simétrica focal (ESF), por acción de ETX, lesión característica del sistema nervioso central, observada principalmente en la enterotoxemia por C. perfringens D (Ali-Nasir et al., 2015). En el caso de la enteritis producida por C. perfringens B histológicamente se podrá apreciar la pérdida de las vellosidades intestinales (necrosis de epitelio con restos de fibrina). Si el hospedador sobrevive, la atrofia será más evidente (Kusiluka & Kambarage, 1996). En casos agudos no es común la presencia de infiltrado inflamatorio, aunque puede llegar a observarse. Además, es probable encontrar los bacilos Gram positivos asociados con la mucosa intestinal. A excepción de ESF, las lesiones intestinales son similares a la enteritis observada por C. perfringens (Uzal & Songer, 2008).
Enterotoxemia por C. perfringens C
Debido a que C. perfringens tipo B y C comparten la síntesis y secreción de CPB, los signos clínicos y lesiones son similares entre las infecciones producidas por ambos toxinotipos (Garcia et al., 2012; He et al., 2023). Sin embargo, en algunos serotipos de C. perfringens C se puede observar la participación de CPE en la patogenia. Esto es debido a que CPB se transcribe a partir de ADN plasmídico, y en algunos serotipos, este plásmido también puede encontrarse CPE (Kiu & Hall, 2018). La toxina CPE es el principal factor de virulencia de C. perfringens F, también puede estar presente en C. perfringens D. La toxina CPE de Clostridium perfringens actúa a través de la unión a proteínas de la familia claudina, proteínas de membrana celular localizadas en el borde apical de las células epiteliales intestinales. Se ha reconocido como receptores a las proteínas claudina 3, 4, 6, 8 y 14, mientras que el ligando específico se encuentra en la porción amino terminal de la toxina. Una vez que la toxina se une con los receptores específicos, se forman pequeños complejos multiproteicos sobre la membrana celular del enterocito. Al unirse al menos seis de estos complejos se da lugar a la formación del poro (inserción de la toxina en la membrana celular, b-barril), que es permeable a calcio. Finalmente, el ingreso excesivo de calcio produce muerte celular (Navarro et al., 2018). La acción de CPE se manifiesta a través del daño de los enterocitos (principalmente en el íleon, aunque toda la mucosa intestinal es susceptible), produciendo oncosis y necrosis. Esto promueve cambios en la permeabilidad celular del epitelio intestinal lo que produce diarrea. La acción de esta toxina se manifiesta como eritema a nivel sistémico e inflamación (enteritis) a nivel local (Shrestha et al., 2018).
En la mayoría de las especies domésticas C. perfringens C produce enterocolitis, enteritis necrótica y enterotoxemia en neonatos (Garcia et al., 2012). Los signos clínicos incluyen dolor abdominal agudo, depresión y diarrea sanguinolenta en diferentes especies (Cooper & Songer, 2010). La semiótica en animales, así como la sintomatología en humanos es de carácter agudo e hiperagudo, con mortalidad elevada. La enteritis en animales adultos por C. perfringens tipo C se caracteriza por una diarrea persistente y deshidratación (Garcia et al., 2012). En ovinos se ha relacionado la infección de este toxinotipo con muerte súbita en adultos (enfermedad conocida como “struck” en inglés). Las lesiones sistémicas por esta enterotoxemia no son específicas. Puede haber congestión pulmonar, edema y hemorragia (Redondo, 2015).
Enterotoxemia por C. perfringens D
La principal toxina producida por C. perfringens tipo D es ETX (Uzal et al., 2018), cuyos receptores y mecanismos de acción a nivel celular fueron descritos con anterioridad. Esta es una de las toxinas más potentes conocidas en el ambiente, con una dosis letal de 100 ng en ratones (Losada-Eaton & Fernandez-Miyakawa, 2010). Este toxinotipo produce la principal enterotoxemia (de curso agudo, subagudo o crónico) observada en ovinos y caprinos. Existen pocos reportes de enterotoxemia de tipo D en becerros en comparación con borregos y cabras (Uzal & Songer, 2008; Pawaiya et al., 2020). El curso agudo es más común en animales no vacunados o animales jóvenes, con una mortalidad cercana al 100%, sin la aparición de signos clínicos o lesiones (Layana et al., 2006). ETX también está presente en C. perfringens B, y al igual que C. perfringens D, puede observarse presentaciones clínicas similares. Ha sido descrita como una toxina potente a nivel neurológico, que aumenta la presión vascular, produce contractibilidad del músculo liso y edema pulmonar (Figura 1).

Es la principal causante de colitis en caprinos. A nivel cerebral, la toxina produce deterioro endotelial vascular y también produce edema. Este edema causa daño de los astrocitos (primero hinchazón y después ruptura). También se ha reportado que es citotóxica para las neuronas. El conjunto de estos daños es observado en el paciente como hemorragia cerebral. La hemorragia y el daño de los astrocitos produce necrosis del parénquima cerebral (Gangwar et al., 2021). Es esta necrosis del parénquima (morfológicamente observada como necrosis focal bilateral) la causante de los signos clínicos neurológicos como opistótonos (Figura 2), convulsiones, respiración forzada con espuma en cavidad oral y narinas, recumbencia con pataleo, entre otros. En rumiantes se ha asociado la enterotoxemia del tipo D a cambios repentinos en la dieta. Las dietas altas en carbohidratos (granos) o dietas altas en forraje fresco pueden producir el ambiente intestinal idóneo para la proliferación de C. perfringens D. Se ha determinado que algunos fármacos, como fenotiazina y netobimina pueden favorecer la enterotoxemia por C. perfringens D. La diarrea es un signo ocasional que puede observarse en ovinos. En caprinos la semiótica en adultos incluye diarrea hemorrágica, dolor abdominal, convulsiones y opistótonos. La muerte sobreviene de 2 a 4 días posterior a la aparición de los signos clínicos (Uzal et al., 2018).

La forma crónica de la enfermedad, tanto en ovinos y caprinos, puede durar días; incluso semanas. Esta presentación ocurre en animales vacunados y la semiótica comprende diarrea acuosa con moco, debilidad, dolor abdominal, anorexia y disminución de producción láctea (Uzal & Songer, 2008). En las lesiones microscópicas causadas por C. perfingens tipo D se observa congestión de los vasos sanguíneos en la corteza cerebral (Gangwar et al., 2021). En ovinos con enterotoxemia crónica se ocasiona una hernia del vermis cerebelar. Otra de las lesiones características es la ESF, caracterizada por focos hemorrágicos oscuros en cuerpo estriado, tálamo, mesencéfalo y pedúnculos cerebelares, aunque también aparece en corteza cerebral e hipocampo. En el 90% de los casos se observan lesiones microscópicas en el cerebro, mismas que son consideradas patognomónicas (Uzal, 2004). Estas lesiones se definen patológicamente como edema perivascular proteináceo. Microscópicamente la ESF se observa como una degeneración de la sustancia blanca, hemorragia e hinchazón celular de astrocitos y degeneración axonal (Salvarani et al., 2019). El edema perivascular, la degeneración y necrosis del parénquima cerebral son siempre bilaterales y simétricos. Otras lesiones durante la necropsia incluyen edema pulmonar, daño vascular endolelial y hemorragia en endocardio (Figura 3).

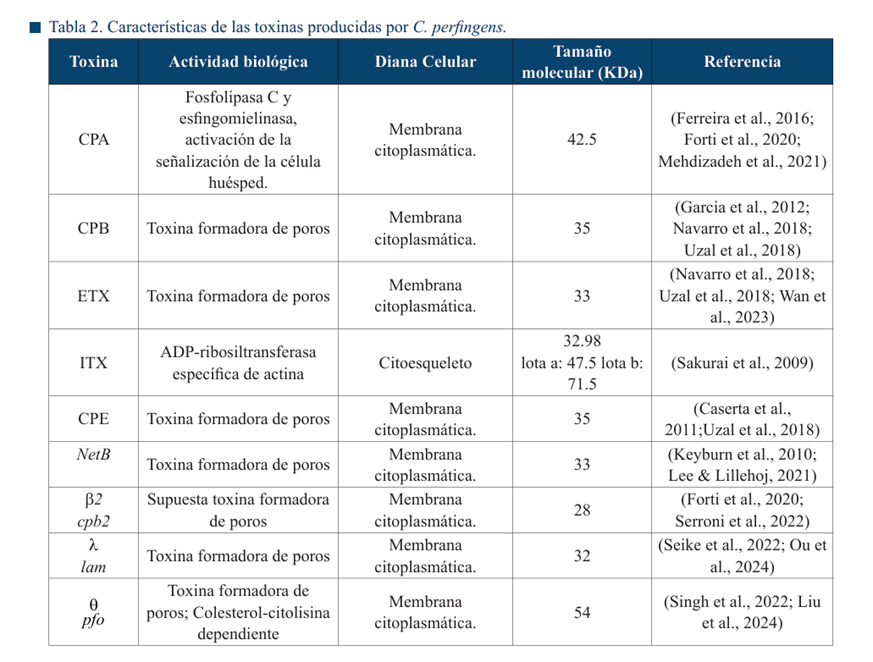
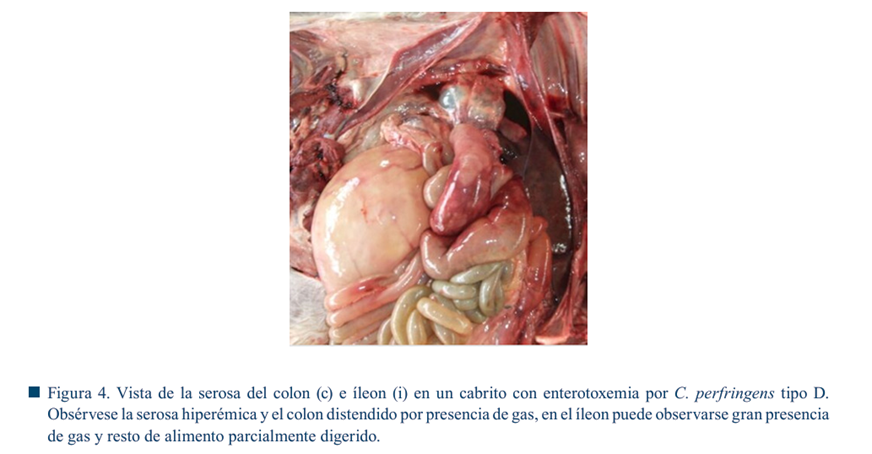
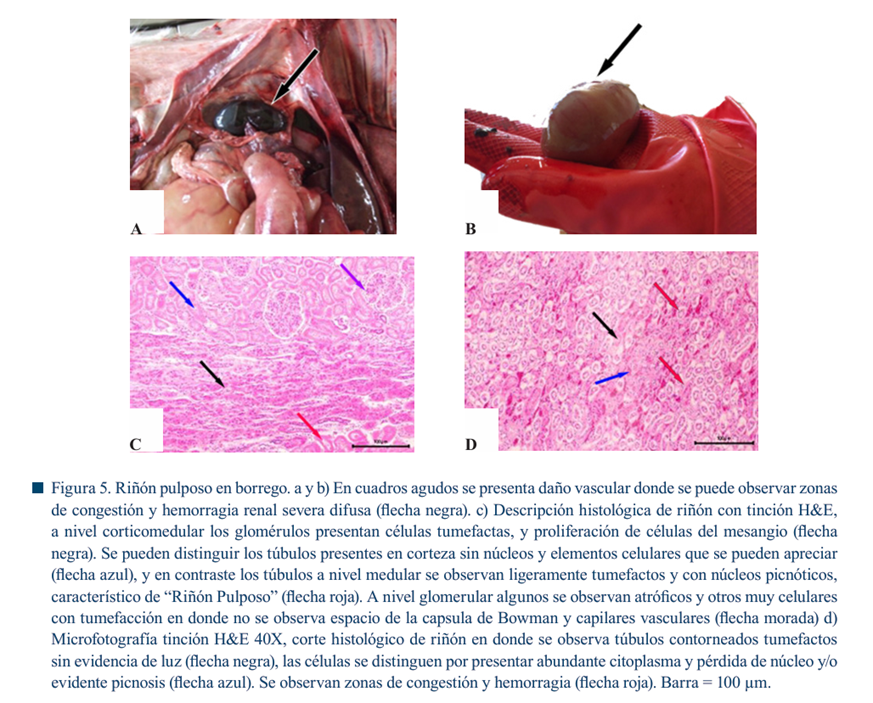
La enteritis se caracteriza por hiperemia en la mucosa con restos sanguinolentos (con o sin residuos de fibrina) aunque puede no encontrarse en casos agudos e hiperagudos (Gangwar et al., 2021). La serosa intestinal se observa con petequias. En caprinos, la forma crónica de la enfermedad cursa con colitis fibrinohemorrágica. En algunas ocasiones, el íleon puede verse involucrado (Figura 4) (Ali Nasir et al., 2015). La consistencia del riñón (Figura 5 a-d), del cual deriva el nombre de la enfermedad “riñón pulposo”, es un cambio post mortem, característica únicamente observada en ovinos (Redondo, 2015).
Enterotoxemia por C. perfringens E
Este toxinotipo se encuentra normalmente en la microbiota de mamíferos. La principal toxina secretada por C. perfringens tipo E es la ITX (Sakurai et al., 2009). La toxina ITX de Clostridium perfringens está compuesta de dos componentes, Ia e Ib. La protoxina Ib es activada por proteólisis en el intestino, lo que da lugar a la unión con el receptor de Lipoproteína estimulada por lipólisis (LSR), así como el antígeno CD44. Una vez internalizada Ib forma poros funcionales en la membrana celular, lo que permite la internalización de Ia, proteína con función enzimática. Al igual que Ib, Ia se secreta como protoxina que necesita ser activada por proteólisis. La acción enzimática de Ia produce la despolimerización de los filamentos de actina, por lo que el citosqueleto de los enterocitos se ve afectado. El efecto tóxico se traduce en desorganización inter e intracelular y aumento de la permeabilidad (Navarro et al., 2018). La desorganización celular produce inhibición de endocitosis (atrofia funcional), inhibición de la migración, activación de leucocitos e inhibición de la contracción del músculo liso (Mada et al., 2023). Aunque hay una clara asociación de la toxina en la patogenia en estudios in vitro, la toxemia in vivo ha mostrado resultados controversiales (Navarro et al., 2018).
C. perfringens E produce enteritis en bovinos, ovinos y conejos. En estos últimos hospedadores es probable que la enteritis sea causada por una toxina similar a ITX, producida por C. spiroforme. (Uzal et al., 2018). La semiótica incluye diarrea y pérdida de la condición corporal. En ocasiones puede ocasionar muerte súbita en becerros del tipo cárnico. Algunas lesiones encontradas en la necropsia incluyen la presencia de hemorragias, tanto en la mucosa como en la serosa del ciego. El íleon distal y el colon proximal pueden verse también afectados. Al interior del íleon y colon afectados puede hallarse exudado catarral. Histológicamente se observa necrosis del epitelio superficial y hemorragia de la submucosa (Figura 6) (Redondo, 2015).

Enterotoxemia por C. perfringens F
Se ha descrito que algunas cepas del toxinotipo C. perfringens E tienen relación genética y antigénica el toxinotipo C. perfringens F (Mada et al., 2023). La enteritis producida por C. perfringens tipo F es debida fundamentalmente a la toxina CPE (Uzal et al., 2018). La acción de esta toxina, así como sus receptores fue descrita anteriormente. Este toxinotipo es común en diferentes especies animales y forma parte de la microbiota intestinal en animales adultos (Shrestha et al., 2018). Se ha reportado colitis en caprinos y enteritis de leve a moderada en cerdos, equinos y perros. Estas presentaciones clínicas no son letales, sin embargo, la asociación directa con CPE en animales con diarrea no ha sido concluyente (Uzal et al., 2018). Por otro lado, en seres humanos se trata de la segunda causa más común de intoxicación por consumo de alimentos contaminados (Shrestha et al., 2018). El problema de salud púbica tiene una alta correlación con el consumo de carne mal cocida, ya que al albergar esporas de C. perfringens F estas pueden germinar al interior del intestino. Aunado a ello, el consumo directo de alimentos de origen animal contaminados con estos bacilos promueve su esporulación en el intestino. Una vez que se forma la espora, se libera la toxina a nivel intestinal (Mehdizadeh Gohari et al., 2023). También se ha observado una colonización aumentada de C. perfringens tipo F en pacientes que han recibido antibioterapia prolongada. La manifestación clínica se observa como diarrea y malestar generalizado, usualmente con buen pronóstico de mejoría.
En casos excepcionales, se ha reportado enterotoxemia relacionada con constipación o medicación utilizando fármacos que producen constipación (Shrestha et al., 2018).
Enterotoxemia por C. perfringens G
La principal toxina producida por C. perfringens G es NetB, al igual que muchas toxinas secretadas por C. perfringens esta proviene de un plásmido conjugativo (Lee & Lillehoj, 2021). La investigación sobre esta toxina ha confirmado su participación directa en la enteritis necrótica en aves. NetB es una toxina formadora de poros cuyo receptor celular no ha sido reconocido. La toxina forma poros en la membrana de los enterocitos, lo que permite la entrada de iones como sodio, cloro y calcio, lo que puede conducir a la lisis osmótica y necrosis. El efecto observado es la destrucción del epitelio intestinal (Navarro et al., 2018). Por otro lado, se ha reconocido que C. perfringens G que no presentan NetB ha sido aislado de casos de enteritis necrótica en pollos de engorda, por lo que se cree que existen otros factores de virulencia que pueden trabajar en sinergia para producir lesiones características (entre ellos CPA, hialuronidasas, sialidasas, entre otros) (Lee & Lillehoj, 2021).
En aves comerciales la causa principal de enteritis necrótica son los coccidios del género Eimeria spp. por lo que la infección con C. perfringens G forma parte del diagnóstico diferencial (Uzal et al., 2018). Por otro lado, se han reportado algunos casos aislados de enteritis necrótica en aves producida por C. perfringens A. Este hallazgo supondría que CPA podría estar involucrada en la patogenia de la enteritis necrótica por C. perfringens en aves (Mohiuddin et al., 2023). La presentación clínica se observa en aves de engorda (pollo, pavos) de dos a seis semanas de edad, aunque se han reportado casos en aves de mayor edad. De igual forma, se ha reportado enteritis necrótica en especies de aves silvestres (Rood et al., 2018). La presentación clínica puede ser aguda, subaguda o crónica. La semiótica en los casos agudos incluye diarrea, anorexia, resistencia a moverse, entre otros. En algunos casos, la mortalidad es elevada sin que aparezcan signos clínicos. En la presentación subaguda, el signo característico es la pérdida progresiva de la condición corporal y como consecuencia la afectación en la ganancia de peso. Las lesiones de la enteritis necrótica de las aves no son muy diferentes a la enteritis producida por C. perfringens en mamíferos. En los casos agudos el íleon y yeyuno se encuentran afectados, sin embargo, todo el intestino delgado puede mostrar lesiones, e incluso alcanzar el ciego. En pollos de engorda el intestino se muestra distendido por presencia de gas, mientras que la serosa se observa hemorrágica. En la mucosa es común encontrar exudado fibronecrótico de color café obscuro, así como una ulceración del epitelio (Mohiuddin et al., 2023). No es común observar hemorragia en la luz intestinal. En los casos subagudos o crónicos las lesiones son similares, se observa una marcada inflamación y engrosamiento de la serosa intestinal. En algunos casos el hígado puede verse afectado (colangiohepatitis), encontrando el tejido friable y pálido con múltiples focos necróticos. Microscópicamente se puede observar necrosis difusa multifocal en la mucosa. La infiltración de heterófilos en la submucosa pone en evidencia un proceso inflamatorio. Asimismo, se presentan bacilos Gram positivos mezclados con tejido necrótico y en descamación (Caserta et al., 2011).
CONCLUSIONES
Los diferentes toxinotipos de Clostridium perfringens aparecen en las distintas presentaciones de la enfermedad y provocan daño a nivel intestinal. Algunas toxinas son absorbidas en el torrente sanguíneo y causan daño a otros tejidos, como lo es el sistema nervioso central, aparato urinario o músculo. Aunque el daño puede observarse como una mortalidad elevada en animales domésticos, existen factores que favorecen el crecimiento exponencial de estas bacterias en el intestino (tales como el cambio de dieta en algunos rumiantes). El reconocimiento de las lesiones en los diversos tejidos, tanto macroscópicamente como microscópicamente constituye el paso fundamental para establecer el diagnóstico.
REFERENCIAS
Abd El-Hack, M. E., El-Saadony, M. T., Elbestawy, A. R., El-Shall, N. A., Saad, A. M., Salem, H.
M., El-Tahan, A. M., Khafaga, A. F., Taha, A. E., AbuQamar, S. F., & El-Tarabily, K. A. (2022).
Necrotic enteritis in broiler chickens: disease characteristics and prevention using organic
antibiotic alternatives – a comprehensive review. Poultry Science, 101(2), 101590.
https://doi.org/10.1016/j.psj.2021.101590
Ali Nasir, A., Younus, M., Rashid, A., Abdul Khaliq, S., Khan, E., Shah, S. H., Aslam, A., Ghumman, M. A.,
& Joiya, M. H. (2015). Clinico-pathological findings of Clostridium perfringens type D
enterotoxaemia in goats and its hemolytic activity in different erythrocytes. Iranian Journal
of Veterinary Research, 16(1), 94-99.
Bokori‐Brown, M., Savva, C. G., Fernandes da Costa, S. P., Naylor, C. E., Basak, A. K., & Titball, R. W.
(2011). Molecular basis of toxicity of Clostridium perfringens epsilon toxin. The FEBS
journal, 278(23), 4589-4601.
Caserta, J. A., Robertson, S. L., Saputo, J., Shrestha, A., McClane, B. A., & Uzal, F. A. (2011). Development
and application of a mouse intestinal loop model to study the in vivo action of Clostridium
perfringens enterotoxin. Infection and Immunity, 79(8), 3020-3027. https://doi.org/10.1128/
IAI.01342-10
Cooper, K. K., & Songer, J. G. (2010). Virulence of Clostridium perfringens in an experimental
model of poultry necrotic enteritis. Veterinary Microbiology, 142(3-4), 323-328. https://
doi.org/10.1016/j.vetmic.2009.09.065
Cooper, K. K., Songer, J. G., & Uzal, F. A. (2013). Diagnosing clostridial enteric disease in poultry.
Journal of Veterinary Diagnostic Investigation, 25(3), 314-327. https://doi.org/10.1177/
1040638713483468
Eroksuz, Y., Otlu, B., Calicioglu, M., Eroksuz, H., Akdeniz Incili, C., Karabulut, B., & Abayli, H. (2018).
Enterotoxemia caused by Clostridium perfringens type E in a Calf. Kafkas Universitesi
Veteriner Fakultesi Dergisi, 24(6), 905-908. https://doi.org/10.9775/kvfd.2018.19952
Ferreira, M., Moreira, G., Cunha, C., Mendonça, M., Salvarani, F., Moreira, Â., & Conceição, F.
(2016). Recombinant alpha, beta, and epsilon toxins of Clostridium perfringens: production
strategies and applications as veterinary vaccines. Toxins, 8(11), 340. https://doi.org/10.3390/
toxins8110340
Finnie, J. W., & Uzal, F. A. (2024). Neurotoxicity of Clostridium perfringens type D enterotoxemia.
In Natural Molecules in neuroprotection and Neurotoxicity Chapter 31. M. R. Oliveira (Ed.),
(pp. 701-717). Academic Press. https://doi.org/10.1016/B978-0-443-23763-8.00066-X
Forti, K., Ferroni, L., Pellegrini, M., Cruciani, D., De Giuseppe, A., Crotti, S., Papa, P., Maresca,
C., Severi, G., Marenzoni, M. L., & Cagiola, M. (2020). Molecular characterization of
Clostridium perfringens strains isolated in Italy. Toxins, 12(10), 650. https://doi.org/10.3390/
toxins12100650
Freedman, J. C., McClane, B. A., & Uzal, F. A. (2016). New insights into Clostridium perfringens
epsilon toxin activation and action on the brain during enterotoxemia. Anaerobe, 41, 27-31.
https://doi.org/10.1016/j.anaerobe.2016.06.006
Gangwar, N. K., Pawaiya, R. V. S., Gururaj, K., Singh, D. D., Andani, D., Kumar, A., Sharma, D. K.,
Rao, A. R., & Rai, A. (2021). Chemotactic factor inducing Interleukin-8 (IL8) gene
is transcriptionally elevated in experimental enterotoxaemia in goats caused by Clostridium
perfringens type D. Heliyon, 7(7), e07568. https://doi.org/10.1016/j.heliyon.2021.e07568
Garcia, J. P., Beingesser, J., Fisher, D. J., Sayeed, S., McClane, B. A., Posthaus, H., & Uzal, F. A. (2012).
The effect of Clostridium perfringens type C strain CN3685 and its isogenic beta toxin null
mutant in goats. Veterinary Microbiology, 157(3-4), 412-419. https://doi.org/10.1016/j.
vetmic.2012.01.005
Grenda, T., Jarosz, A., Sapała, M., Grenda, A., Patyra, E., & Kwiatek, K. (2023). Clostridium
perfringens—Opportunistic foodborne pathogen, Its diversity and epidemiological significance.
Pathogens, 12(6), 1-12. https://doi.org/10.3390/pathogens12060768
Hassan, K. A., Elbourne, L. D. H., Tetu, S. G., Melville, S. B., Rood, J. I., & Paulsen, I. T. (2015).
Genomic analyses of Clostridium perfringens isolates from five toxinotypes. Research in
Microbiology, 166(4), 255-263. https://doi.org/10.1016/j.resmic.2014.10.003
He, X., Ye, G., Xu, S., Chen, X., He, X., & Gong, Z. (2023). Effects of three different probiotics of
Tibetan sheep origin and their complex probiotics on intestinal damage, immunity, and immune
signaling pathways of mice infected with Clostridium perfringens type C. Frontiers in
Microbiology, 14(April), 1-13. https://doi.org/10.3389/fmicb.2023.1177232
Jayaraman, S., Thangavel, G., Kurian, H., Mani, R., Mukkalil, R., & Chirakkal, H. (2013). Bacillus
subtilis PB6 improves intestinal health of broiler chickens challenged with Clostridium
perfringens-induced necrotic enteritis. Poultry Science, 92(2), 370-374. https://doi.org/10.3382/
ps.2012-02528
Keyburn, A. L., Bannam, T. L., Moore, R. J., & Rood, J. I. (2010). NetB, a Pore-forming toxin
from necrotic enteritis strains of Clostridium perfringens. Toxins, 2(7), 1913-1927. https://
doi.org/10.3390/toxins2071913
Kiu, R., & Hall, L. J. (2018). An update on the human and animal enteric pathogen Clostridium
perfringens. Emerging Microbes and Infections, 7(1). https://doi.org/10.1038/s41426-018-
0144-8
Kusiluka, L., & Kambarage, D. (1996). Diseases of small ruminants a handbook: Common diseases
of sheep and goats in Sub-Saharan Africa. VETAID. https://assets.publishing.service.gov.
uk/media/57a08dbfed915d3cfd001bba/R5499-Diseases-of-Small-Ruminants.pdf
Layana, J. E., Fernandez Miyakawa, M. E., & Uzal, F. A. (2006). Evaluation of different fluids for
detection of Clostridium perfringens type D epsilon toxin in sheep with experimental
enterotoxemia. Anaerobe, 12(4), 204-206. https://doi.org/10.1016/j.anaerobe.2006.05.001
Lee, K.-W., & Lillehoj, H. S. (2021). Role of Clostridium perfringens necrotic enteritis B-like toxin
in disease pathogenesis. Vaccines, 10(1), 61. https://doi.org/10.3390/vaccines10010061
Liu, Z., Mou, S., Li, L., Chen, Q., Yang, R., Guo, S., Jin, Y., Liu, L., Li, T., Chen, H., & Wang, X. (2024).
The barrier disruption and pyroptosis of intestinal epithelial cells caused by perfringolysin
O (PFO) from Clostridium perfringens. Cells, 13(13), 1140. https://doi.org/10.3390/cells
13131140
Losada-Eaton, D. M., & Fernandez-Miyakawa, M. E. (2010). Clostridium perfringens epsilon toxin
inhibits the gastrointestinal transit in mice. Research in Veterinary Science, 89(3), 404-408.
https://doi.org/10.1016/j.rvsc.2010.04.006
Mada, T., Goto, Y., Kumagai, M., Sakai, H., Kanamori, H., & Takamatsu, D. (2023). A calf with hind
limb paralysis and dysstasia and a genome sequence analysis of an isolated Clostridium
perfringens toxinotype E strain. Journal of Veterinary Medical Science, 85(3), 279-289.
https://doi.org/10.1292/jvms.22-0432
Mehdizadeh G.I., A. Navarro, M., Li, J., Shrestha, A., Uzal, F., & A. McClane, B. (2021). Pathogenicity
and virulence of Clostridium perfringens. Virulence, 12(1), 723-753. https://doi.org/10.108
0/21505594.2021.1886777
Mehdizadeh G.I., Li, J., Navarro, M. A., Mendonça, F. S., Uzal, F. A., & McClane, B. A. (2023).
Identification of orphan histidine kinases that impact sporulation and enterotoxin production
by Clostridium perfringens type F strain SM101 in a pathophysiologically-relevant ex vivo
mouse intestinal contents model. PLOS Pathogens, 19(6), e1011429. https://doi.org/10.1371/
journal.ppat.1011429
Mohiuddin, M., Song, Z., Liao, S., Qi, N., Li, J., Lv, M., Lin, X., Cai, H., Hu, J., Liu, S., Zhang, J.,
Gu, Y., & Sun, M. (2023). Animal model studies, antibiotic resistance and toxin gene profile
of NE reproducing Clostridium perfringens type A and type G strains isolated from commercial
poultry farms in China. Microorganisms, 11(3). https://doi.org/10.3390/microorganisms11030622
Morris, W. E., & Fernández-Miyakawa, M. E. (2009). Toxinas de Clostridium perfringens. Revista
Argentina de Microbiologia, 41(4), 251-260.
Muneeb, M., Khan, E. U., Ahmad, S., Naveed, S., Ali, M., Qazi, M. A., Ahmad, T., & Abdollahi, M. R.
(2024). An updated review on alternative strategies to antibiotics against necrotic enteritis
in commercial broiler chickens. World’s Poultry Science Journal, 1–50.
Navarro, M. A., McClane, B. A., & Uzal, F. A. (2018). Mechanisms of action and cell death associated
with Clostridium perfringens toxins. Toxins, 10(5), 1–21. https://doi.org/10.3390/toxins10050212
Ou, L., Ye, B., Sun, M., Qi, N., Li, J., Lv, M., Lin, X., Cai, H., Hu, J., Song, Y., Chen, X., Zhu, Y.,
Yin, L., Zhang, J., Liao, S., & Zhang, H. (2024). Mechanisms of intestinal epithelial cell
damage by Clostridium perfringens. Anaerobe, 87, 102856. https://doi.org/10.1016/j.anaerobe.
2024.102856
Pawaiya, R. S., Gururaj, K., Gangwar, N. K., Singh, D. D., Kumar, R., & Kumar, A. (2020). The
challenges of diagnosis and control of enterotoxaemia caused by Clostridium perfringens in
Small Ruminants. Advances in Microbiology, 10(05), 238-273. https://doi.org/10.4236/
aim.2020.105019
Redondo, L. M. (2015). Rol de las toxinas binarias en las enfermedades intestinales causadas por
clostridios enterotóxicos. 51. http://repositoriouba.sisbi.uba.ar/gsdl/collect/posgraafa/index/
assoc/HWA_1143.dir/1143.PDF
Rood, J. I., Adams, V., Lacey, J., Lyras, D., McClane, B. A., Melville, S. B., Moore, R. J., Popoff, M. R.,
Sarker, M. R., Songer, J. G., Uzal, F. A., & Van Immerseel, F. (2018). Expansion of the
Clostridium perfringens toxin-based typing scheme. Anaerobe, 53, 5-10. https://doi.org/10.1016
/j.anaerobe.2018.04.011
Sakurai, J., Nagahama, M., Oda, M., Tsuge, H., & Kobayashi, K. (2009). Clostridium perfringens
iota-toxin: structure and function. Toxins, 1(2), 208-228.
Salvarani, F. M., Faccin, M., Freitas, N. F. D. Q. R., de Matos, M. R., Garcia, E. C., Pagliosa, G. M.,
& de Marco Viott, A. (2019). Outbreak of Clostridium perfringens type D enterotoxeia in
sheep. Veterinary Medicine, 40(6), 2593-2602.
Seike, S., Takehara, M., Kobayashi, K., & Nagahama, M. (2022). Critical residues of Clostridium
perfringens delta-toxin for oligomerization and receptor binding. BPB Reports, 5(3), 66-69.
https://doi.org/10.1248/bpbreports.5.3_66
Serroni, A., Colabella, C., Cruciani, D., Ciullo, M., Crotti, S., Papa, P., Di Paolo, A., Gobbi, M.,
Forti, K., Pellegrini, M., Salini, R., D’Avino, N., Cagiola, M., Pezzotti, G., & De Giuseppe, A.
(2022). Identification and characterization of Clostridium perfringens atypical CPB2 Toxin
in cell cultures and field samples using monoclonal antibodies. Toxins, 14(11), 796. https://
doi.org/10.3390/toxins14110796
Shrestha, A., Uzal, F. A., & McClane, B. A. (2018). Enterotoxic clostridia: Clostridium perfringens
enteric diseases. Microbiology Spectrum, 6(5), 139-148. https://doi.org/10.1128/microbiolspec.
GPP3-0003-2017
Singh, A., Rawat, P., Choudhury, D., & Dixit, A. (2022). Immunogenic and neutralization efficacy of
recombinant perfringolysin O of Clostridium perfringens and its C-terminal receptor-binding
domain in a murine model. Immunologic Research, 70(2), 240-255. https://doi.org/10.1007
s12026-021-09254-9
Uzal, F. A. (2004). Diagnosis of Clostridium perfringens intestinal infections in sheep and goats.
Anaerobe, 10(2), 135-143. https://doi.org/10.1016/j.anaerobe.2003.08.005
Uzal, F. A. (2010). Clostridium Perfringens toxins involved in mammalian veterinary diseases.
Open Toxinology Journal, 2(1), 24-42. https://doi.org/10.2174/1875414701003010024
Uzal, F. A., Giannitti, F., & Asin, J. (2022). Yellow lamb disease (Clostridium perfringens Type A
enterotoxemia of sheep): A review. Animals, 12(12), 1-9. https://doi.org/10.3390/ani12121590
Uzal, F. A., Navarro, M. A., Li, J., Freedman, J. C., Shrestha, A., & McClane, B. A. (2018). Comparative
pathogenesis of enteric clostridial infections in humans and animals. Anaerobe, 53, 11–20.
https://doi.org/10.1016/j.anaerobe.2018.06.002
Uzal, F. A., & Songer, J. G. (2008). Diagnosis of Clostridium perfringens intestinal infections in
sheep and goats. Journal of Veterinary Diagnostic Investigation, 20(3), 253-265. https://
doi.org/10.1177/104063870802000301
Wan, W., Li, Y., Wang, J., Jin, Z., Xin, W., Kang, L., Wang, J., Li, X., Cao, Y., Yang, H., Wang, J.,
& Gao, S. (2023). PLGA nanoparticle-based dissolving microneedle vaccine of Clostridium
perfringens ε toxin. Toxins, 15(7). https://doi.org/10.3390/toxins15070461
Zaragoza, N. E., Orellana, C. A., Moonen, G. A., Moutafis, G., & Marcellin, E. (2019). Vaccine
production to protect animals against pathogenic clostridia. Toxins, 11(9), 1-29. https://doi.
org/10.3390/toxins11090525