Técnicas de coprocultivo en rumiantes / Santos Martínez (2024)
Técnicas de obtención y cultivo de larvas L3 de nematodos gastrointestinales de rumiantes
Techniques for abtaining and culture of L3 larvae of ruminant gastrointestinal nematodes
Alfonso Pedro Santos Martínez1*
*Autor para correspondencia: pedrosantostmz1995@gmail.com Fecha de recepción: 2 de mayo de 2024
Fecha de aceptación: 3 de julio de 2024 Fecha de publicación: 8 de agosto de 2024
1Universidad Autónoma Benito Juárez de Oaxaca, Facultad de Medicina Veterinaria y Zootecnia. Oaxaca, México.
![]()
Resumen
Los nematodos gastrointestinales de rumiantes presentan un ciclo de reproducción similar, en su tercer estadio, afectan al huésped. Los coprocultivos permiten obtener los diferentes estadios. El objetivo de esta revisión fue brindar un panorama general de las técnicas de coprocultivo para la obtención de larvas L3 de los nematodos gastrointestinales de rumiantes. La búsqueda de información se realizó con buscadores académicos vinculados a recursos originales y verídicos: Web of Science, Google Académico, Scopus, Dialnet, SciELO y PubMED. Se seleccionaron aquellas publicaciones que abordaron técnicas de cultivos de nematodos gastrointestinales de rumiantes: bovinos, caprinos y ovinos. En el proceso de obtención de larvas se deben tomar en cuenta factores como la carga parasitaria, traslado de muestras al laboratorio, monitoreo de la humedad, temperatura y un material inerte que permita la oxigenación de las muestras. El mantenimiento de la fase infectante requiere aislar y proporcionar un medio alimenticio para garantizar su supervivencia.
Palabras clave: desarrollo larval, helmintos, parasitosis.
Abstract
Gastrointestinal nematodes of ruminants have a similar reproductive cycle, in their third stage, they affect the host. Stool cultures allow obtaining the different stages. The objective of this review was to provide an overview of the stool culture techniques for obtaining L3 larvae of ruminant gastrointestinal nematodes. The search for information was carried out using academic search engines linked to original and veridical resources: Web of Science, Google Scholar, Scopus, Dialnet, SciELO and PubMED. We selected those publications that dealt with culture techniques of gastrointestinal nematodes of ruminants: cattle, goats and sheep. In the process of obtaining larvae, factors such as parasite load, transfer of samples to the laboratory, monitoring of humidity, temperature and inert material that allows oxygenation of the samples must be taken into account. The maintenance of the infective stage requires isolation and provision of a feeding medium to guarantee its survival.
Keywords: larval development, helminths, parasitosis.
Introducción
A nivel mundial, los nematodos gastrointestinales (NGI) tienen un impacto negativo en la ganadería (Szew et al., 2021), ocasionan retraso en el crecimiento y reproducción, disminución en la producción de leche y mala conversión alimenticia (Figueroa-Antonio et al., 2018; Márquez, 2014). Estos nematodos son de cuerpo redondo, filiformes, dioicos, con dimorfismo sexual y presentan de cuatro a cinco mudas durante su desarrollo (López, 2019). Estos habitan el tubo digestivo y son de importancia, principalmente en los sistemas extensivos (Reyes-Guerrero et al., 2021).
De forma natural, existe una coevolución en la relación entre los nematodos gastrointestinales y sus hospederos. Coexisten con niveles leves o moderados, sin afectar la salud y producción del hospedador; sin embargo, existen condiciones que provocan que esta relación pierda su homeostasis y el nivel de infestación se eleve ocasionando una serie de efectos perjudiciales (Ortiz et al., 2022).
Los principales NGI de los rumiantes reportados en la literatura pertenecen al orden Trichostrongyloidea, suborden Strongylida, géneros: Cooperia, Trichostrongylus, Haemonchus, Oesophagostomum, Ostertagia y Nematodirus (Soca et al., 2007; Guerrero et al., 2017). Cada especie de NGI, en sus diferentes fases larvarias, habitan en un tejido. Generalmente, en la fase adulta, se localizan en el epitelio de la mucosa o en la luz gastrointestinal. El estadio L3 es la etapa infecciosa, suele encontrarse en la pastura. En condiciones de humedad o rocío tienden a ascender sobre los tallos u hojas (Balic et al., 2000).
Las acciones adecuadas para el manejo y control de los NGI requieren la determinación de las especies presentes en las unidades de producción. Por lo que se recomienda, como primera instancia, realizar coprocultivos que permitan identificar con mayor precisión las especies presentes (Ensuncho et al., 2014). Es sumamente complejo establecer coprocultivos de nematodos con poblaciones homogéneas debido a su carácter de parásitos obligados (Orozco et al., 2009). En este contexto, el objetivo de este trabajo de revisión fue brindar un panorama general de las técnicas de coprocultivo para la obtención de larvas L3 de NGI de rumiantes.
DESARROLLO DEL TEMA
Ciclo biológico de los nematodos gastrointestinales de los rumiantes
Generalmente, los nematodos gastrointestinales de los rumiantes presentan un ciclo de vida similar (Figura 1). Su sobrevivencia, desarrollo y distribución en el forraje están en función con las condiciones ambientales (Zajac & Garza, 2020). El ciclo de vida de los NGI se divide en dos fases: exógena y endógena. La fase exógena inicia con la liberación de huevos en las heces fecales al exterior, la eclosión a L1 y el desarrollo a L2, por otra parte, la fase endógena inicia con la ingesta de las larvas L3, luego pasa al desarrollo de la fase madura L4 y L5 listos para la reproducción (Soca et al., 2005).
Los huevos liberados al medioambiente eclosionan en larva L1, entre las 24 y 30 horas, teniendo condiciones óptimas de temperatura: 28 °C y humedad relativa al 80%, de lo contrario pueden permanecer durante meses sin eclosionar (Hernández, 2011). Luego que el huevo eclosiona, la L1 dura de dos a tres días y se transforma a L2. Después, de cuatro a siete días, sufren una segunda muda para evolucionar a L3 en ambiente con temperatura de 22 a 26 °C, a menos de 9 °C suspenden su desarrollo o bien mantienen la cubierta o vaina de L2.
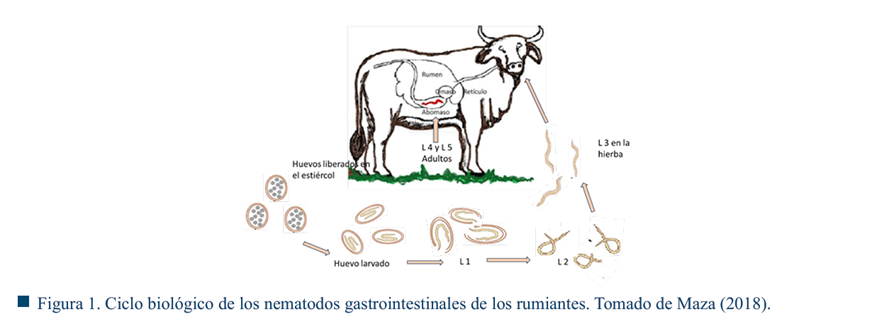
Bajo esta circunstancia, al ser ingeridos, llegan al rumen. En él existe un incremento del pH ruminal, ocasionado por la secreción de la enzima leucinoamino-peptidasa. Las células neurosecretoras de la larva causan la liberación de la cubierta, después de 10 y 20 minutos migran hacia el abomaso donde penetran en las fosas gástricas o criptas de las glándulas gástricas para transformarse en L4. En dos días posteriores se desplazan de la mucosa hacia el lumen abomasal para evolucionar a L5. Estas maduran en los siguientes dos días, las hembras comienzan a depositar huevos entre los 21 y 28 días posterior a la infección (Aguilar-Caballero et al., 2009). En estadio L4, en el abomaso, pueden permanecer en hipobiosis de 10 a 14 días durante periodos de adversidad climática como frío excesivo o periodo de secas. En general, las larvas de los NGI pueden completar su fase endógena en el huésped de tres a cinco meses, muchas se mueren y otros se calcifican formando nódulos (Aguilar-Caballero et al., 2011). Es importante mencionar que las L3 pueden permanecer en el medio ambiente de uno a tres meses (Fox, 1997).
Extracción de muestras coprológicas
En la toma de muestras de heces fecales para la determinación de carga parasitaria, para fines de coprocultivo, es importante considerar, en la toma de muestras, el criterio de no haber recibido tratamientos antihelmínticos en un período igual o mayor a 60 días (Olazarán et al., 2019). Se sugiere tomar muestras en las primeras horas de la mañana, antes que el animal inicie actividades físicas que exijan mucho movimiento o gasto de energía (Chuchuca, 2019; Puicón et al., 2022), entre las 7:00 y 9:00 a.m. Preferentemente, recolectar las heces directamente del recto (Campos-López, 2017; Martínez-Martínez et al., 2021). En esta labor es importante utilizar materiales limpios y de preferencia estériles, con la finalidad de no alterar las características de la muestra. Se recomienda utilizar guantes de látex para su extracción, al obtenerla en las manos se debe invertir el guante para su almacenamiento y evitar la contención de aire (Méndez, 2019), también las bolsas nuevas de polietileno para la extracción y almacenamiento (Zaragoza-Vera et al., 2017). De igual forma, es efectiva la recolección de muestras fecales inmediatamente o en la exacta defecación. Es necesario el uso de guantes, así como una espátula para la recolección de las heces depositadas, se puede almacenar en colector universal estéril (Maristela et al., 2017). Es importante evitar la contaminación con nematodos de vida libre (Olivares, 2023). Finalmente, no se debe olvidar rotular los contenedores, bolsas y guantes (Maurizio et al., 2023).
Criterios en carga parasitaria para el coprocultivo
La carga parasitaria es un determinante en la cantidad de larvas a obtener a partir de coprocultivos. Dey et al., (2020) mencionan que se debe utilizar heces en pool o individualizada con una carga de al menos 200 huevos por gramo (HPG). En esta misma sintonía, los criterios en la homogeneización de la carga parasitaria por grupos de animales infestados y cumplirán con el objetivo de la investigación (Pedrozo-Prieto et al., 2015).
Traslado de muestras coprológicas para coprocultivo
El traslado de muestras al laboratorio, para fines de coprocultivos, deberá tener buen manejo para incrementar su viabilidad. Ramírez et al., (2022) recomiendan colocarlas en una hielera a temperatura 10±2 °C. Si las muestras no se conservan inmediatamente o el traslado el lento o mal adecuado, aparecerán huevos embrionados y larvados. Esto puede alterar los resultados, incluso arrojar resultados negativos, aunque el paciente esté parasitado. Córdova et al., (2021) recomiendan la idoneidad de su transportación, al laboratorio o almacenamiento, en refrigeración a 6 °C. Si se utiliza caja de telgopor con refrigerantes, deben ir individualizadas, sin conservantes y tapadas correctamente para evitar derrame de líquidos y contaminación (Robles et al., 2011). Se debe impedir que las muestras estén en contacto directo con hielo o anticongelante, ya que se pueden congelar y favorecer la formación de cristales que dañan ciertos tejidos, disminuyendo la viabilidad de eclosión de los huevos o el desarrollo de las larvas. El tiempo de refrigeración es otro factor que determina su viabilidad. No debe exceder de 24 horas a partir de su recolección (Benavides, 2013), aunque puede refrigerarse hasta por siete días; sin embargo, la emergencia puede verse reducida hasta un 17% (Munguía-Xóchihua et al., 2023).
Técnicas de coprocultivo para la obtención de L3
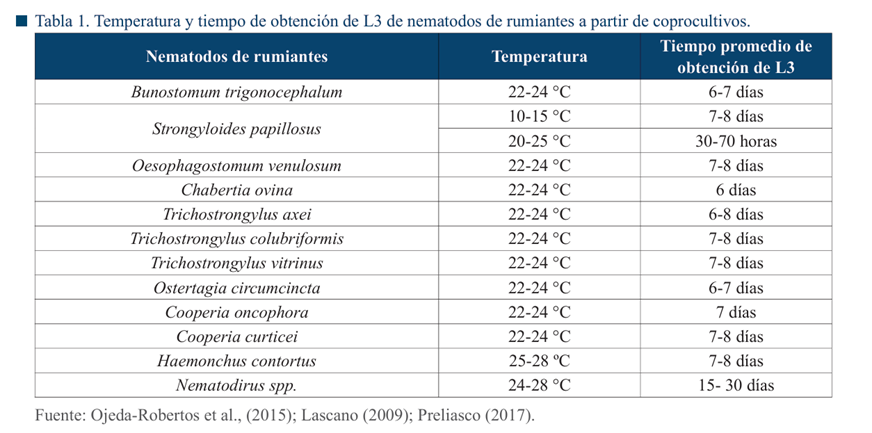
Existen varias técnicas que promueven la maduración de los huevos para la eclosión, así como el desarrollo de las larvas hasta la fase infectante, mediante coprocultivo. Todas tienen los mismos principios y dependen de tres factores, de acuerdo con Fiel et al., (2011), las heces deben tener una humedad adecuada, un material inerte para facilitar la oxigenación y una temperatura idónea, este último puede variar con las especies de los NGI y por ende influye en el tiempo de desarrollo a L3, como se puede observar en la Tabla 1.
En un trabajo realizado por Montoya et al., (2005) reportan el uso de muestra fecal bovina con aserrín puro y relaciones 1:1, 1:0.75 y 1:0, se colocaron en cajas de Petri con la adición de unas gotas de carbonato de calcio al 1.5% para evitar el crecimiento de hongos, se guardaron a temperatura ambiente con aireación periódicamente y a los 12 días se obtuvieron las L3. De forma similar, Dias et al., (2018) recomiendan mezclar 20 g de heces con virutas de madera esterilizadas y mantenerlas húmedas a una temperatura controlada de 25 °C durante siete días.
Álvarez et al. (2007) describen el uso 5 g de heces con 2 g del aserrín humedecidos con agua destilada colocados en frascos de vidrio, se incubaron a 27 ºC con una humedad relativa del 70%, para extraer las larvas se llenaron los frascos con agua a 30 ºC, se cubrieron con tapas de caja Petri, después se invirtieron para su reposo por 2 h, luego se realizó la recolección del líquido con las larvas acumulas en las tapas con una pipeta Pasteur.
Leandro-Picado et al., (2020) combinaron 10 g de heces de bovinos con 10 g de aserrín de Laurusnobilis spp. (laurel) y 40 ml de agua destilada. Se usaron frascos de vidrio, tapados con papel aluminio perforado, se incubaron a 27 °C por ocho días. Se llenaron los frascos con agua destilada a 37 °C, se taparon con placas de Petri, durante 2 h y se colocaron de forma invertida, se agregaron 16 ml de agua destilada a 37 °C en el interior de cada placa hasta cubrir los alrededores del frasco. A partir de los 30 minutos se observó la migración larval.
Se ha registrado el uso carbón activado con muestras fecales en proporción 1:3, se mezclan con agua hasta obtener una pasta y se cubren con papel de aluminio. Se colocan bajo incubación de 25 a 28 ºC durante siete días, se monitorea por las mañanas para mantener la humedad óptima y al día 8 se procede a aislar las larvas L3 con el uso de placas de Petri (Rajpoot et al., 2017).
Sánchez-Salgado et al., (2021) trabajaron con cultivos que fueron colocados en recipientes de plástico y mezclados con partículas de poliestireno. Para promover la eclosión de los huevos se incorporó agua y oxigenación adecuada en el día seis. Después se realizó la recuperación de las larvas L3 con la técnica de Baermann por un período de 24 h.
García (2019) realizó un coprocultivo en el que utilizó heces húmedas trituradas de ovino, se añadió hule de espuma para favorecer la aireación, se mantuvo con humedad a temperatura ambiente de 25 a 35 °C durante siete días y se permitió aireación cada tres días.
La técnica desarrollada por Pimentel (2020) requiere de un recipiente plástico con capacidad de 15 ml, 8 g de materia fecal, 4 g de vermiculita y 5 ml de agua destilada. Luego de homogeneizar la mezcla se cubre el recipiente con gasa, se invierte el frasco para hacer pequeñas perforaciones en la base y permitir la aireación. Se incuba en estufa de 24 a 26 ºC y transcurridos 14 días se recuperan las L3 por el método de Baermann.
Por otro lado, puede combinar materia fecal de bovino, vermiculita y agua de grifo con una consistencia pastosa en vasos de cultivo, incubar durante 10 a 12 días a 27 °C, se revisa diariamente para asegurar un ambiente ligeramente húmedo. Transcurridos los días, se llenan los vasos con agua e invierten en una placa de Petri durante la noche sin luz, se recogen los L3 del sobrenadante en la placa (Scott et al., 2019).
Sargison et al., (2018) transfirieron las L1 en un disco de papel de filtro de algodón colocado en una placa de Petri que contenía 5 ml de un cultivo de Escherichia coli OP50 en caldo Luria/estreptomicina, se colocó el papel filtro con las L1 en bolsas de plástico perforadas y se llevaron a una incubadora hermética con 24 °C durante 7 días. Después se recuperan las L3 con el método de Baermann.
En otro procedimiento, en vasos de plásticos desechables, las heces húmedas de ovino cubren ¾ y se incuban de 26-28 °C. Se le permite la aireación todos los días por dos horas, a temperatura ambiente y a partir del día siete se inicia la obtención de las L3 (Preliasco, 2017). Igualmente, Cerutti (2017) señala la viabilidad de materia fecal en recipientes plásticos puestos en una cámara húmeda a 25 °C durante 12 a 15 días.
En un método, adaptado por Benavides (2012), se combina la materia fecal con papel picado y se humedecen con agua. La mezcla obtenida se coloca en vasos de precipitado de cristal, se cubren con cajas de Petri, no se requiere de incubadora ya que se puede colocar en espacios a temperatura ambiente y protegido de la luz solar de siete a quince días hasta obtener las L3, generalmente al día siete se puede observar la colonización del hongo Pilobolus spp.
Hernández et al., (2023) compararon la efectividad de diversos coprocultivos realizados con carbón, aserrín, vermiculita y agua en un experimento con dos repeticiones. Se concluyó que el uso de aserrín fue apropiado ya que permitió obtener una mayor cantidad de larvas en comparación con los demás sustratos.
Es importante tener experimentos con varias repeticiones, ya que las larvas en cualquier estadio podrán inducir la hipobiosis, este puede ser causado por utilizar estadios intermedios, contaminación de las muestras y poca cantidad de materia fecal (Arcila & Benavides, 2002).
Mantenimiento de larvas L3
Existe escasa información sobre técnicas de mantenimiento de nematodos gastrointestinales vivos L3, Alcalá et al., (2019) describen un método de cultivo in vitro de L3 de Haemonchus contortus en frascos de cultivo celular rectangular de 75 cm con filtro de tapón, a 37 °C, atmósfera de CO2 5%, así como medio ontogénico se mezcla 44.2 ml de Medio RPMI+HEPES, 0.246 ml de antibiótico-antimicótico (Penicilina G sódica de 100.0 UI + Estreptomicina de 100.0 µg), 0.492 ml de Anfotericina-B y 0.08 ml de eritrocitos de ovino lavados con solución VyM, el cambio de L3 a L4 es de 0 a 56 días.
Ray y Mansfield (1995) señalan que para mantener las L3 bajo condiciones in vitro en matraces con una solución salina equilibrada de Earle (EBSS) se debe adicionar penicilina G, 250 U ml-1, sulfato de estreptomicina 250 µg ml-l, cloranfenicol 350 µg ml-1 y como suplemento P/S/CAMP.
Estos se mantienen a 37 °C con 5% de CO2, en un lapso de 48 a 96 horas las L3 se pueden evolucionar a L4. Marie-Magdeleine et al., (2009) agregaron 6 ml de cultivo nutritivo de agar en una caja Petri con las L3 y fueron selladas con Parafilm. Esta se coloca bajo condiciones óptimas para permitir mantener vivas las larvas.
Aislamiento de larvas L3
Alaro et al., (2023) utilizaron la técnica de Baermann que consiste en adaptar un pedazo de tubo de goma sobre el cuello del embudo del aparato de Baermann, ahí se quedarán atrapadas las larvas, se envuelve con gasas, la muestra de heces, luego se colocar en una coladera para ser instalada sobre el embudo. Se llena con agua hasta cubrir la mitad de la muestra y se dejar reposar de 8 a 12 horas. Se recomienda usar agua tibia porque la temperatura es un factor que favorece la migración larvaria (Castillo et al., 2015).
En la técnica de Roberts y O’Sullivan (1950), citada por Prada (2008), se coloca la muestra fecal en un frasco y se llena con agua tibia hasta el borde, posteriormente taparlo con una placa Petri y se invierte de modo que el vaso se coloque boca abajo con la placa durante 24 horas y después ser extraída con una pipeta. Así también, se puede colocar en una posición ligeramente inclinada, durante 4 a 5 horas para retirar el agua que contiene las larvas (Afreen et al., 2019).
En la obtención de larvas, con la menor cantidad posible de impurezas, se recomienda usar una pipeta de Pasteur, tomar la fase acuosa para depositarlo en un tubo de ensayo y centrifugar a 4000 rpm por cuatro minutos, luego descartar el sobrenadante (Rodríguez-Molano et al., 2018).
CONCLUSIONES
Existen diferentes técnicas de coprocultivos para obtener L3 en rumiantes. Tienen los mismos principios, un ambiente adecuado para la eclosión de los huevos y larvas, temperatura de 20-28 °C, aireación de al menos una hora por día y un material inerte que permita la circulación del aire en la muestra. El control de estos factores determina los resultados en la obtención de la fase L3 de 6 a 30 días, según la especie de interés. Aún es limitada la información de las técnicas de mantenimiento de las L3, L4 y L5. Es importante continuar con investigaciones que permitan obtener soluciones o alternativas para reducir diversos problemas de parasitismo.
REFERENCIAS
Afreen, F. J., Palanivelrajan, M., Gomathinayagam, S. & Jayathangaraj, M. G. (2019). Copro-culture
study of nematode larvae in Black Bucks (Antilope cervicapra). The Indian Veterinary Journal,
96(1), 38-40.
Aguilar-Caballero, A., Torres-Acosta, F. & Cámara-Sarmiento, R. (2009). Importancia del parasitismo gastrointestinal en ovinos y situación actual de la resistencia antihelmíntica en México. Avances en el control de la parasitosis gastrointestinal de ovinos en el trópico. Universidad Autónoma Chapingo, México.
Aguilar-Caballero, A., Torres-Acosta, F., Cámara-Sarmiento, R. & Sandoval-Castro, C. A. (2011).
El control de los nematodos gastrointestinales en caprinos: ¿dónde estámos? Bioagrociencias,
4(2), 1-16.
Alaro, T., Dulo, F., Wodajo, W. & Mathewos, L. (2023). Anthelmintic resistance of gastrointestinal
nematodes of communally-grazing goats in Humbo District, Southern Ethiopia, Veterinary
Medicine. Research and Reports, 14, 185-194. https://doi.org/10.2147/VMRR.S434584.
Alcalá, C. Y., Álvarez, M. J. A., Cruz. V. C., Escutia, S. I., Figueroa, M. J., Liébano, H. E., López,
A. M., Neri, O. S., Ramírez, V. G., Rojas, M. C. & Vega, M. C. (2019). Técnicas para el
diagnóstico de parásitos con importancia en salud pública y veterinaria. Cultivo y mantenimiento de parásitos vivos. Editor. AMPAVE-CONASA. México, D.F.
Álvarez, C. V., Hernández, J. & Wing, C. R. (2007). Eficacia de aserrines para inhibir el desarrollo
in vitro de larvas de parásitos gastrointestinales de ovinos. Agronomía Costarricense, 31(1),
71-75. https://www.redalyc.org/pdf/436/43631108.pdf.
Arcila, G. J. L. & Benavides, M. J. A. (2002). Toma de muestras y técnicas de diagnóstico parasitológico en
materia fecal. ICA Informa, 1, 51-54. http://hdl.handle.net/20.500.12324/18172.
Balic, A., Bowles, V. M. & Meeusen, E. N. (2000). The immunobiology of gastrointestinal nemato de infections in ruminants. Advance in Parasitology, 45(181-241) https://doi.org/10.1016/S0065-308X(00)45005-0.
Benavides, O. E. (2012). Enseñanza de la parasitología veterinaria a partir del uso de organismos
vivos y tecnologías de la información y de la comunicación (TIC). Revista Medicina Veterinaria, 23 (97-10). https://doi.org/10.19052/mv.78.
Benavides, O. E. V. (2013). Técnicas para el diagnóstico de endoparásitos de importancia veterinaria.
Veterinaria y Zootecnia, 11, Colombia, Universidad de la Salle, 180 p. https://doi.org/10.19052/9789585136366.
Campos-López, N., Zaragoza-Vera, C. V., Arjona-Jiménez, G., Zaragoza-Vera, M., González-
Garduño, R., Chan-Escalante, R. A., Cámara-Sarmiento, R. & Aguilar-Caballero, A. J. (2017).
Efecto del tamaño de camada sobre la carga parasitaria gastrointestinal durante la lactancia
en ovejas Pelibuey. Avances de la investigación sobre producción de ovinos de pelo en
México (1ª ed). Universidad Juárez Autónoma de Tabasco, Instituto Tecnológico de la Zona
Maya e Instituto Tecnológico de Chiná. 232 p.
Cerutti, J. (2017). Técnica de inmunofluorescencia para identificación de huevos del género Haemonchus
en ovinos. Universidad Nacional de la Plata. https://sedici.unlp.edu.ar/handle/10915/111934.
Chuchuca, C. A. M. (2019). Prevalencia de parasitosis intestinal en el ganado bovino mediante el
análisis coprológico cuantitativo. Universidad Politécnica Salesiana. http://dspace.ups.edu.
ec/handle/123456789/17638.
Córdova, G. N. L., León, L. E. Q., Almeyda, M. E. D., Sánchez, E. V. & Bravo, G. A. C. (2021).
Gastrointestinal parasites in cattle in from peasant communities of Santa Cruz, Cajamarca-Perú.
Brazilian Journal of Development, 7(8), 77250-63. https://doi.org/10.34117/bjdv7n8-102.
Dey, A. R., Begum, N., Anisuzzaman, Alim, M. A. & Alam, M. Z. (2020). Multiple anthelmintic
resistance in gastrointestinal nematodes of small ruminants in Bangladesh. Parasitology
International, 77, 102105. https://doi.org/10.1016/j.parint.2020.102105.
Dias, L. F., Lopes, A. R. C., Costa, S. L. P., Magri, F. C., Ribeiro, B. F. & Victor, J. A. (2018).
Coadministration of nematophagous fungi for biological control over nematodes in bovine
in the South-Eastern Brazil. BioMed Research International, 1(1-6), 2934674 https://doi.
org/10.1155/2018/2934674.
Ensuncho, H. C., Castellano, C. A., Maza, Á. L., Bustamante, Y. M. & Vergara, G. O. (2014).
Prevalencia y grado de infección de nematodos gastrointestinales en ovinos de pelo en
pastoreo de cuatro municipios de Córdoba, Colombia. Revista Científica, 8(5). pp. 414-420.
https://www.redalyc.org/pdf/959/95932260005.pdf.
Fiel, C. A., Steffan, P. E. & Ferreyra, D. A. (2011). Diagnóstico de las parasitosis más frecuentes
de los rumiantes: técnicas de diagnóstico e interpretación de resultados. Universidad
Nacional del Centro de la Provincia de Buenos Aires. Argentina. 131 p.
Figueroa-Antonio, A., Pineda-Rodríguez, S.A., Godínez-Jaime, F., Vargas-Álvarez, D. & Rodríguez-
Bataz, E. (2018). Parásitos gastrointestinales de ganado bovino y caprino en Quechultenango,
Guerrero, México. Agroproductividad, 11(6), 97-104. https://revista-agroproductividad.org/
index.php/agroproductividad/article/view/438/318.
Fox, M. T. (1997). Pathophysiology of infection with gastrointestinal nematodes in domestic
ruminants: recent developments. Veterinary parasitology, 72(3-4), 285-308. https://doi.org/10.1016/S0304-4017(97)00102-7.
García, A. C. A. (2019). Actividad antihelmíntica in vitro e in vivo de extractos de planta silvestre y
raíces pilosas de Waltheria americana Linn. [Tesis de maestría, Universidad Autónoma del
Estado de Morelos]. http://riaa.uaem.mx/handle/20.500.12055/1812.
Guerrero, L., Rossini, M., Bethencourt, A., Colmenares, O., Rueda de Arvelo, E., & Ríos de
Álvarez, L. (2017). Efecto de la suplementación con semilla de Canavalia ensiformis sobre
parásitos gastrointestinales y comportamiento productivo de corderas Wesest African.
Revista de la Facultad de Ciencias Veterinarias, 58(1), 24-33.
Hernández Barral, Á. (2011). Estudio de la respuesta inmune frente a Haemonchus contortus en dos
razas ovinas canarias. [Tesis doctoral]. http://hdl.handle.net/10553/6295.
Hernández, A. D., Kantner, B., Santos, E., Major, S., Carr, R. & Li, Y. (2023). The number of
Oesophagostomum spp. larvae recovered in coprocultures varies with media used. Journal
of Helminthology, 97. https://doi.org/10.1017/S0022149X23000391.
Lascano, G. C. P. (2009). Taninos condensados y su efecto sobre los parásitos gastrointestinales de
ovinos. Universidad de la Salle, Bogotá. Colombia. https://ciencia.lasalle.edu.co/medicina_
veterinaria/322.
Leandro-Picado, A. M., Calderón-Sancho, A. & Alfaro-Mora, R. (2020). Evaluación del tiempo en
la recuperación de larvas de nematodos a partir de un coprocultivo. Revista Colombiana de
Ciencia Animal - RECIA, 12(1), 744. https://doi.org/10.24188/recia.v12.n1.2020.744.
López, M. Y. (2009). Identificación de nematodos gastrointestinales de bovinos cebú a inicios de
época lluviosa en la EEAS – UNCP 2008. [Tesis de Licenciatura, Universidad Nacional del
Centro de Perú]. http://hdl.handle.net/20.500.12894/1920.
Marie-Magdeleine, C., Hoste, H., Mahieu, M., Varo, H. & Archimede, H. (2009). In vitro effects
of Cucurbita moschata seed extracts on Haemonchus contortus. Veterinary Parasitology,
161(1-2), 99-105. https://doi.org/10.1016/j.vetpar.2008.12.008.
Maristela, P. E., Spacagna, J. R. & de Campos, N. A. H. (2017). Manual veterinario de toma y envío de muestras: manual técnico. Cooperación técnica MAPA/OPS/PANAFTOSA para el fortalecimiento de los programas de salud animal de Brasil. https://iris.paho.org/handle/10665.2/34527.
Márquez, L. D. (2014). Control sostenible de los nematodos gastrointestinales en rumiantes. Corporación Colombiana de Investigación Agropecuaria-CORPOICA. http://hdl.handle.net/20.500.12324/12620.
Martínez-Martínez, R., de Jesús Pérez-Bautista, J., Hernández-Mogica, M., Lemus, M. T. G.,
Hernández, I. D. J. A. & Pedroza, S. I. M. (2021). Identificación y conteo de parásitos
gastrointestinales en ovinos Dorper en Atlapexco, Hidalgo, México. Ecosistemas y Recursos
Agropecuarios, 8(2). https://doi.org/10.19136/era.a8nII.2873.
Maurizio, A., Marchiori, E., Tessarin, C. & Cassini, R. (2023). Comparing pooled and individual
samples for estimation of gastrointestinal strongyles burden and treatment efficacy in small
ruminants. Veterinary Parasitology, 318, 109935. https://doi.org/10.1016/j.vetpar.2023.109935.
Maza, L. J. (2018). Caracterización bioquímica parcial y funcional de las proteínas de secreción de
70 kDa derivadas de larvas L4 del nematodo Haemonchus placei. [Tesis de Maestría, Universidad Autónoma del Estado de Morelos].
Méndez, S. M. (2019). Análisis hematológicos y parasitológicos en pequeños rumiantes. Universidad
Nacional, Costa Rica. http://hdl.handle.net/11056/17663.
Montoya, F. N., Bengoa, V. E. P. & Pinillos, D. M. B. (2005). Evaluación de técnicas para la
conservación y cultivo de parásitos gastrointestinales en primates de vida silvestre. Revista
de Medicina Veterinaria, 9, 47-57.
Munguía-Xóchihua, J., Reyna-Granados, J., Leyva-Corona, J. & Morales-Pablos, M. (2023). Tolerancia de muestras de heces fecales a diferentes tiempos de refrigeración para la recuperación de larvas infectantes de Haemochus contortus en bioensayos coproparasitológicos con ovinos. Revista Latinoamericana de Recursos Naturales, 19(2), 36-41.
Ojeda-Robertos, N. F., Torres-Acosta, J. F., Mendoza-de Gives, P., Gonzalez-Garduņo, R., Valero-Coss, R. O., Liébano-Hernández, E. & Ayala-Burgos, A. (2015). Optimizing the use of Duddingtonia flagrans chlamydospores against Haemonchus contortus in feces of sheep. Tropical and Subtropical Agroecosystems, 18(3). http://dx.doi.org/10.56369/tsaes.2115.
Olazarán, J. S., Arellano, M. E., López, I., De Gives, P. & Juárez, A. (2019). Evaluación de la
resistencia antihelmíntica de nematodos gastrointestinales a bencimidazol en ovinos en el
estado de Puebla. Investigaciones Científicas y Agrotecnológicas para la Seguridad Alimentaria,343.
Olivares, S. M. I. (2023). Notas y apuntes: material, toma y envío de muestras biológicas para
diagnóstico de laboratorio veterinario. Facultad de Medicina Veterinaria y Zootecnia,
Universidad Nacional Autónoma de México.
Orozco, M., Álvarez, V., Jiménez, A. & Acuña, Ó. (2009). Evaluación in vitro de hongos nematófagos
para el control biológico de nematodos gastrointestinales de rumiantes. Revista MVZ Córdoba,
14(3), 1820-1830.
Ortiz, M. C. M., de Jesús, T. A. J. F., Ojeda, R. N. F., González, R. L. & Muñoz, M. S. A. (2022).
Manejo integrado de parásitos en pequeños rumiantes. Bioagrociencias, 15(2).
Pedrozo-Prieto, R., Britos-Moreno, B., Chirife-Cardozo, C. & Sandoval-Candia, C. (2015). Efecto
del uso de moxidectina sobre la carga parasitaria y eritrograma de corderos en tres
establecimientos ubicados en el distrito de Hernandarias, Paraguay. Compendio de Ciencias
Veterinarias, 5(1), 36-42. https://doi.org/10.18004/compend.cienc.vet.2015.05.01.36-42.
Pimentel, B. S. (2020). Puesta a punto y validación de metodologías basadas en ADN para diagnóstico
de nematodos gastrointestinales de ovinos, en Uruguay. [Tesis de maestría, Universidad de la
República Uruguay]. https://hdl.handle.net/20.500.12008/27248.
Preliasco, F. A. (2017). Estudio in vitro del efecto de Baccharis trimera sobre Haemonchus contortus.
[Tesis Doctoral, Universidad de la República de Uruguay]. https://hdl.handle.net/20.500.12008/25025.
Puicón, V., López-Flores, A., Fabian-Dominguez, F. & Sánchez-Cárdenas, H. (2022). Prevalencia
coprológica de parásitos intestinales en humanos y porcinos de crianza de traspatio del
distrito de Zapatero, San Martín. Revista de Veterinaria y Zootecnia Amazónica, 1(1), 4-14.
https://doi.org/10.51252/revza.v1i1.127.
Rajpoot, J., Shukla, S., Jatav, G. P., Garg, U. K. & Agrawal, V. (2017). Coproculture study of
strongyle infection of goats from Malwa region of Madhya Pradesh. Journal of Entomology
and Zoology Studies, 5(5), 876-878.
Ramírez, A. M., Saldaña-Pérez, L., Arrellano-Rocha, R. E., Chagoya-Sánchez, M., Chávez, A. J. G.
& Angel-Sahagún, C. A. (2022). Prevalencia de parásitos gastrointestinales en pequeños
rumiantes. Jóvenes en la Ciencia, 16, 1-3.
Ray, G. H. & Mansfield, L. S. (1995). Characterization of excretory-secretory products from larval
stages of Haemonchus contortus cultured in vitro. Veterinary Parasitology, 62, 291-305.
https://doi.org/10.1016/0304-4017(95)00871-3.
Reyes-Guerrero, David., Olmedo-Juárez, A. & Mendoza-de Gives, P. (2021). Control y prevención
de nematodosis en pequeños rumiantes: antecedentes, retos y perspectivas en México. Revista
Mexicana de Ciencias Pecuarias, 12(3), 186-204. https://doi.org/10.22319/rmcp.v12s3.5840.
Robles, C. A., Uzal, F. A. & Olaechea, F. V. (2011). Guía de muestreo para el diagnóstico de
enfermedades en ovinos y caprinos. Instituto Nacional de Tecnología Agropecuaria (INTA). Pp. 33
Rodríguez-Molano, C. E., Pulido-Suárez, N. J. & Rodríguez-Montaña, A. (2018). Evaluación de
tres extractos de plantas para inhibir el desarrollo de larvas de los parásitos gastrointestinales
de los ovinos. Revista Cubana de Plantas Medicinales, 23(3).
Sánchez-Salgado, S. F., Castañeda-Ramírez, G. S., Sánchez, J. E. & Aguilar-Marcelino, L. (2021).
Actividad nematicida in vitro de tres cepas de hongos comestibles de Pleurotus spp. contra
Haemonchus contortus (L3) y Nacobbus aberrans (J2). Ibciencias, 4(1).
Sargison, N. D., Redman, E., Morrison, A. A., Bartley, D. J., Jackson, F., Naghra, G., Holroyd, N.,
Berriman, M., Cotton, J. A. & Gilleard, J. S. (2018). A method for single pair mating in an
obligate parasitic nematode. International Journal for Parasitology, 48(2), 159-165. https://
doi.org/10.1016/j.ijpara.2017.08.010.
Scott, H., Gilleard, JS, Jelinski, M., Barkema, HW, Redman, EM, Avramenko, RW, ... & Uehlinger,
FD (2019). Prevalence, fecal egg counts, and species identification of gastrointestinal
nematodes in replacement dairy heifers in Canada. Journal of Dairy Science 102(9). https://
doi.org/10.3168/jds.2018-16115.
Soca, M., Roque, E. & Soca, M. (2005). Epizootiología de los nematodos gastrointestinales de los
bovinos jóvenes. Pastos y forrajes, 28(3). https://www.redalyc.org/pdf/2691/269121675001.pdf.
Soca, M., Simoón, L. & Roque, E. (2007). Árboles y nematodos gastrointestinales en bovinos jóvenes:
Un nuevo enfoque de las investigaciones. Pastos y Forrajes, 30(5), 21-33. https://www.redalyc.org/articulo.oa?id=269120998002.
Szewc, M., De Waal, T. & Zintl, A. (2021). Biological methods for the control of gastrointestinal
nematodes. The Veterinary Journal, 268, 105602. https://doi.org/10.1016/j.tvjl.2020.105602.
Zajac, A. M., & Garza, J. (2020). Biology, epidemiology, and control of gastrointestinal nematodes
of small ruminants. Veterinary Clinics of North America: Food Animal Practice, 36(1), 73-87.
https://doi.org/10.1016/j.cvfa.2019.12.005.
Zaragoza-Vera, C. V., González-Garduño, R., Medina-Reynés, J. U., Berumen-Alatorre, A. C.,
Arjona-Jiménez, G., Zaragoza-Vera, M. & Aguilar-Caballero, A. J. (2017). Resistencia fenotípica de ovinos Blackbelly, Pelibuey y Katahdin contra nematodos gastrointestinales en el trópico húmedo de México. Avances de la investigación sobre producción de ovinos de pelo en México. Universidad Juárez Autónoma de Tabasco, Instituto Tecnológico de la Zona Maya
e Instituto Tecnológico de Chiná. 232 p.