Morfología y morfometría de adultos de Centrocestus formosanus (Digenea: Heterophyidae) desarrollados de metacercarias del bagre de canal, Ictalurus punctatus
Morphology and morphometry of adult phase of Centrocestus formosanus (Digenea: Heterophyidae) from metacercariae of channel catfish, Ictalurus punctatus
Jesús Genaro Sánchez-Martínez1, Lucero Sandoval-González1, Jaime Luis Rábago-Castro2*,
Roberto Pérez-Castañeda1, Lorena Garrido-Olvera3, Luis García-Prieto4
Autor para correspondencia: jrabago@uat.edu.mx Fecha de recepción: 22 de octubre de 2023
Fecha de aceptación: 22 de enero de 2024 Fecha de publicación: 31 de enero de 2024
1Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México. 2Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México.
3Facultad de Ingenieria y Ciencias, Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México.
4Laboratorio de Helmintología, Instituto de Biología, Universidad Nacional Autónoma de México.
Resumen
Para obtener la fase adulta del parásito Centrocestus formosanus, se alimentaron experimentalmente dos ratones con branquias infectadas con metacercarias de C. formosanus de bagre de canal, Ictalurus punctatus en su estadio juvenil, provenientes de una piscifactoría en Tamaulipas, México. Después de siete días, los ratones fueron sacrificados y los parásitos colectados de tubo digestivo se fijaron y conservaron en alcohol al 70%. Los parásitos se procesaron con las técnicas estándar para platelmintos. Los ejemplares obtenidos concuerdan morfológica y morfométricamente con la identificación de C. formosanus. El presente trabajo proporciona datos morfométrícos no considerados en publicaciones previas. Además, es el primer estudio morfológico y morfométrico de adultos de C. formosanus obtenidos experimentalmente de metacercarias de bagre de canal.
Palabras clave: digeneos, peces, metacercarias, helmintos.
Abstract
With the aim of obtaining the adult phase of Centrocestus formosanus, two mice were feed with juvenile Ictalurus punctatus (from a hatchery in Tamaulipas, Mexico) gills, which were infected with C. formosanus metacercariae. After seven days, mice were euthanized and parasites found in the digestive tract were fixed, and conserved in 70% alcohol. Parasites were processed with standard protocols for flatworms. The specimens obtained fit morphological and morphometrically with Centrocestus formosanus. In the present manuscript morphometric data not previously considered are reported. To our knowledge, this is the first study of adults of C. formosanus obtained experimentally of metacercariae from channel catfish.
Keywords: digenean, fish, metacercaria, helminths
Introducción
Centrocestus formosanus (Nishigori, 1924) es una especie de trematodo (Heterophyidae) descrita en Asia y puede ser la causa de muerte en cultivos de peces (Arguedas et al., 2010; Boerlage et al., 2014; Mitchell et al., 2002) o de sus poblaciones silvestres (Cantu et al., 2013; Chai et al., 2012).
Los parásitos adultos de esta especie son helmintos que parasitan el intestino delgado de aves y mamíferos, y que se distribuyen por todo el mundo (Schell, 1970). Su complejo ciclo de vida incluye dos huéspedes intermediarios, siendo los caracoles los primeros huéspedes intermediarios, los peces los segundos huéspedes intermediarios (Gjurcevic et al., 2007) y algunos vertebrados, incluido el humano, como el huésped definitivo (Pinto et al., 2018).
Los digeneos tienen gran importancia debido a los efectos negativos que pueden causar en los peces cultivados y silvestres de agua dulce (Knoff et al., 2011). El daño producido por sus metacercarias se debe a la migración en los órganos blanco y a la intensidad de la infección; estas metacercarias pueden infectar sitios como las aletas, boca, cerebro, músculos, branquias y piel, induciendo una respuesta inflamatoria tisular, granulomatosis, necrosis e incluso la muerte (Paperna & Dzikowski, 2006). En el caso de C. formosanus es una especie altamente específica en las branquias de los peces, pudiendo causar pérdida de la superficie respiratoria (Gjurcevic et al., 2007); esto es debido a la hiperplasia del cartílago y a la hipertrofia de las células epiteliales branquiales, conduciendo muchas veces a la muerte de los peces (Mitchell et al., 2000).
Por otro lado, se han realizado varios informes de infecciones humanas por C. formosanus en Vietnam (Nguyen & Thanh, 2011) y Laos (Chai et al., 2013), pero el pequeño número de casos no fueron suficientes para considerarlo clínica o epidemiológicamente importante, por lo que se requieren más estudios para verificar las infecciones humanas naturales (Han et al., 2008).
En México, C. formosanus fue detectado por primera vez en 1985 en crías de carpa importadas de China, y el único huésped natural definitivo conocido fue la garza Butorides striatus (Scholz & Salgado-Maldonado, 2000). También en este país se han obtenido experimentalmente adultos de C. formosanus empleando pollos, patos y ratones (Arizmendi-Espinosa, 1992), y en otros países empleando ratas (Yousif et al., 2016).
El bagre de canal, Ictalurus punctatus (Ictaluridae), es uno de los principales peces cultivados en México, en él se han reportado 16 especies de parásitos helmintos en el estado de Tamaulipas, incluida la fase larvaria (metacercaria) de C. formosanus (Rábago-Castro et al., 2011; Rosas-Valdez & Pérez-Ponce de León, 2008). Sin embargo, no hay informes confirmados de la presencia de esta especie de parásito, y menos aún que ésta se lleve a cabo mediante los adultos obtenidos experimentalmente.
Considerando lo anterior, el objetivo de este estudio se dividió en dos partes: primero, identificar morfológicamente y morfométricamente las metacercarias como pertenecientes a la especie C. formosanus detectadas en juveniles de Ictalurus punctatus y, segundo, confirmar su identificación mediante la morfología y morfometría del parásito adulto, obtenido mediante la infección experimental de ratones con tejido branquial infectado con metacercarias.
materiales y métodos
El experimento se llevó a cabo en el Laboratorio de Parasitología Acuática, de la Facultad de Medicina Veterinaria y Zootecnia, de la Universidad Autónoma de Tamaulipas. El cuidado y manejo de los animales se realizó de acuerdo con los lineamientos institucionales de bioética y bienestar animal (Número de oficio CBB_19_2).
De un lote de juveniles de bagre de canal, Ictalurus punctatus, proveniente de un estanque de una piscifactoría en Abasolo (Tamaulipas, México) se muestrearon dos ejemplares con un promedio de longitud total de 15 cm y un peso promedio de 27 g de peso; los peces fueron examinados en la piscifactoría para confirmar la presencia de metacercarias del trematodo C. formosanus en sus arcos branquiales. La identificación de las metacercarias se realizó siguiendo la morfometría y morfología referida por Arizmendi-Espinosa (1992). Del mismo lote de bagres se tomó una muestra de 20 peces que fueron llevados al laboratorio señalado. En este sitio, y previa eutanasia, se examinaron dos bagres, encontrándose de 1 a 2 metacercarias por arco branquial. Los ratones fueron infectados con un protocolo basado en Han et al. (2008) con algunas modificaciones. Dos ratones adultos machos (Mus musculus) con un peso promedio de 35 g fueron comprados en una tienda de mascotas. Los ratones se colocaron en un acuario de vidrio y fueron alimentados con el tejido branquial infectado con metacercarias proveniente de los dos bagres examinados en el laboratorio.
A continuación, los ratones fueron alimentados ad libitum con alimento comercial, y suministrándoles agua. Los ratones fueron sacrificados siete días después de la infección mediante una sobredosis de éter en una cámara de eutanasia. El estómago y el intestino de los ratones se examinaron bajo un microscopio compuesto (Carl Zeiss™). Los parásitos detectados fueron recolectados y colocados en una caja de Petri con solución salina (0.8%), y se procesaron de acuerdo con Pritchard & Kruse (1982). Posteriormente, los parásitos recuperados se fijaron con una solución de alcohol-formaldehído-ácido acético (AFA) durante dos horas. Pasado este tiempo, los parásitos fueron lavados para ser almacenados en alcohol etílico al 70%.
Posteriormente, los parásitos se tiñeron con carmín bórax durante 20 minutos, se deshidrataron en una serie de alcohol etílico, se aclararon en xileno y se montaron con resina sintética. Estas muestras se examinaron microscópicamente para determinar su morfología externa y estructura interna. Los parásitos se midieron en µm utilizando un micrómetro ocular (Zeiss™, 464023-9901, CPL, W10X/18, Alemania). Se tomaron fotografías de los parásitos en un microscopio equipado con una cámara digital (Motic™). La identificación de parásitos se realizó según Arizmendi-Espinosa (1992) y Bray et al. (2008).
RESULTADOS
Se obtuvieron 14 especímenes adultos de C. formosanus de los dos ratones infectados. Se encontraron 12 parásitos en la primera sección del intestino delgado y dos en el estómago. In vivo, los parásitos son de forma ovalada a piriforme, aplanados dorsoventralmente, de color gris blanquecino, con un tegumento espinoso, presentan una vesícula excretora de color oscuro y con forma de X.
En la Tabla 1 se muestran el promedio y el rango en µm de las estructuras del parásito. Los organismos montados (Fig. 1) tienen una longitud y un ancho de 320 µm por 180 µm, respectivamente.
La ventosa oral (32.25 µm de largo y 33.75 µm de ancho) está armada con una doble corona espinosa, con un total de 32 espinas circumorales, ligeramente curvadas (16 espinas en cada corona) que varían en longitud de 12 a 14 µm. La boca está ubicada centralmente en la ventosa oral y se conecta con la prefaringe y la faringe (31 µm de largo por 20.25 µm de ancho).
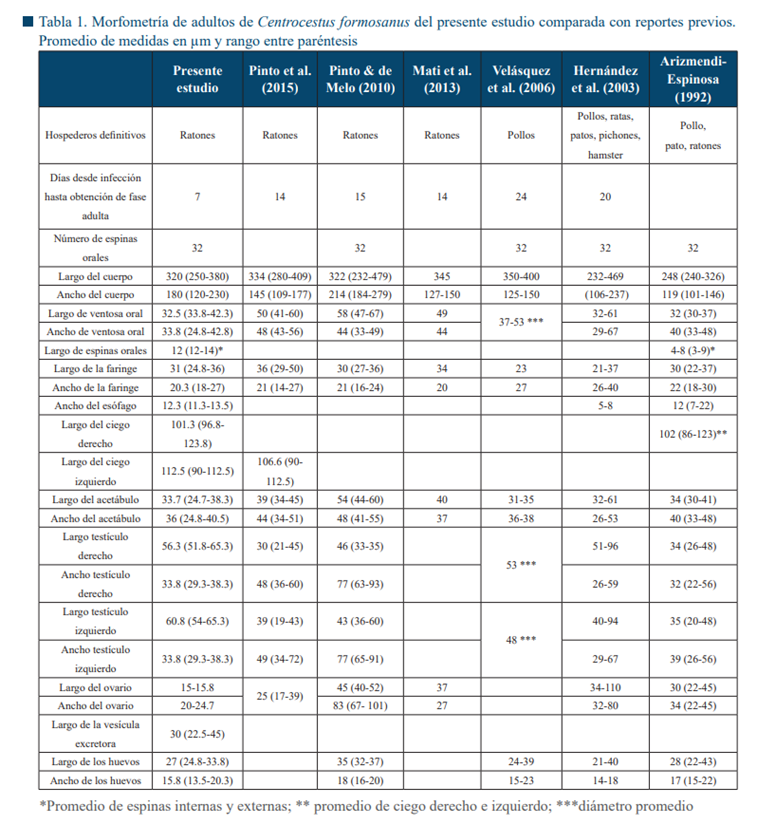
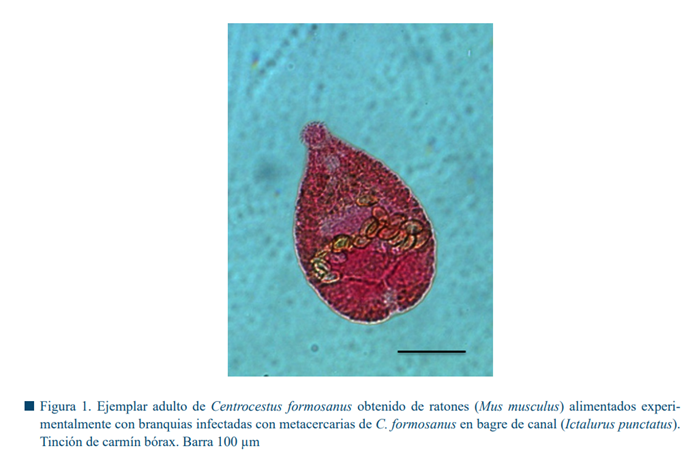
Se continua con un esófago corto (12.25 µm de longitud), que se divide en dos ciegos, los cuales se extienden hasta el extremo posterior del acetábulo.
El ciego derecho mide 101.25 µm de largo y el izquierdo 112.5 µm. El acetábulo se sitúa casi en la mitad del cuerpo, con 33.7 µm de largo y 36 µm de ancho. La vitelaria se encuentra desde el esófago hasta el extremo posterior del cuerpo. Presenta dos testículos opuestos, los cuales están ubicados en el extremo posterior del cuerpo y miden 56.25 µm de largo y 33.75 µm de ancho (derecho) y 60.75 µm de largo y 33.5 µm de ancho (izquierdo). El ovario (15.37 µm de largo y 22.37 µm de ancho) se encuentra entre el acetábulo y el testículo derecho. La vesícula excretora está situada entre los testículos y mide 30 µm de longitud. Los huevos son ovoides y miden 27 µm de largo por 15.75 µm de ancho.
DISCUSIÓN
Centrocestus formosanus es una de las especies de helmintos parásitos más distribuidas en peces de México (Pérez-Ponce de León et al., 2007). Dicha especie tiene el potencial de colonizar regiones geográficamente distantes (Mitchell et al., 2005). Su metacercaria ha sido encontrada en 12 estados de México (Pérez-Ponce de León et al., 2007). La identificación de las metacercarias es posible bajo microscopía óptica con base en sus estructuras, como el tamaño y número de espinas en la doble fila ubicadas en la ventosa oral y la vesícula excretora en forma de X (Arizmendi-Espinosa, 1992), pero de acuerdo con Hop et al. (2007) se logra una identificación más precisa en formas adultas, obtenidas mediante infecciones experimentales de un huésped definitivo y la obtención de estos parásitos completamente desarrollados.
El presente estudio corrobora que los ratones son un buen modelo de huésped definitivo para la etapa adulta de C. formosanus, como se ha reportado (Li et al., 2013; Mati et al., 2013). Una comparación de la morfometría del presente material con las reportadas en estudios previos (Tabla 1) confirma que los adultos obtenidos de los ratones infectados corresponden a C. formosanus. El tamaño de la ventosa oral concuerda con lo reportado en México por Arizmendi-Espinosa (1992), así como el número de espinas circumorales, que es una característica constante del parásito (Arizmendi-Espinosa, 1992).
Las medidas de la faringe en las muestras de este estudio son similares a las reportadas por otros autores (Arizmendi-Espinosa, 1992; Pinto & de Melo, 2010), así como el tamaño del acetábulo (Arizmendi-Espinosa, 1992). Los testículos fueron ligeramente más largos que los reportados por Arizmendi-Espinosa (1992). Por el contrario, las medidas de ovario en las muestras de este estudio son menores que las reportadas por Arizmendi-Espinosa (1992) y Pinto & de Melo (2010), posiblemente también debido a las diferencias en el tiempo post-infección, siete días en este estudio y quince días en el de Pinto & de Melo (2010).
En este trabajo, agregamos dos nuevas mediciones no reportadas previamente: la longitud del ciego izquierdo y la longitud de la vesícula excretora (Tabla 1). Varios factores pueden producir diferencias en la morfometría parasitaria, por ejemplo, el sistema inmune de los hospederos. A este respecto, Pinto et al. (2015) obtuvieron diferencias significativas en el largo y ancho del cuerpo, largo y ancho de testículos y ovarios, y en el número de óvulos en C. formosanus, provenientes de ratones inmunosuprimidos con corticosteroides (Pinto et al., 2015). Asimismo, Arizmendi-Espinosa (1992) utilizó Gallus gallus y Anas sp. con una edad de tres días como huéspedes definitivos, los cuales aún presentan un sistema inmunológico poco desarrollado.
Dado que las infecciones con este parásito pueden provocar la muerte de los peces (Mitchell et al., 2000), el seguimiento de los peces cultivados debe ser constante, así como los procedimientos de cuarentena aplicados cuando se transportan bagres juveniles. En México, existen varios reportes de C. formosanus en peces (Aguilar-Aguilar et al., 2009; Scholz & Salgado-Maldonado, 2000), pero sólo en uno de ellos se confirmó la identificación a través de la obtención de la fase adulta en un huésped definitivo (Arizmendi-Espinosa, 1992).
CONCLUSIONES
A nivel de campo y laboratorio, usualmente solo se realiza un diagnóstico de la infección de C. formosanus mediante el examen del tejido branquial de los peces. Sin embargo, mediante la infección experimental en un modelo animal, por ejemplo ratones, como en el presente bioensayo, se confirma la identificación de este parásito, mediante el estudio de las estructuras y la morfometría de su fase adulta.
AGRADECIMIENTOS
Los autores agradecen al Comité de Sanidad Acuícola de Tamaulipas A.C. por su apoyo en el transporte de los peces.
REFERENCIAS
Aguilar-Aguilar, R., Martínez-Aquino, A., Pérez-Rodríguez, R., Pérez-Ponce-de-León, G. (2009). Digenea, Heterophydae, Centrocestus formosanus (Nishigori, 1924) metacercariae:
Distribution extension for Mexico, new state record, and geographic distribution map. Check
List 5 (2), 357-359. https://doi.org/10.15560/5.2.357
Arguedas, C. D., Dolz, G., Romero-Zúñiga, J. J., Jiménez-Rocha, A. E., & León-Alán, D. (2010). Centrocestus formosanus (Opisthorchiida: Heterophyidae) as a cause of death in gray
tilapia fry Oreochromis niloticus (Perciforme: Cichlidae) in the dry Pacific of Costa Rica.
Revista de Biología Tropical, 58, 1453-1465.
Arizmendi-Espinosa, M. A. (1992). Descripción de algunas etapas larvarias y de la fase adulta de Centrocestus formosanus de Tezontepec de Aldama, Hidalgo. Anales Instituto de Biología.
UNAM, Serie Zoología, 63 (1), 1-11.
Boerlage, A. S., Graat, E. A. M., Verreth, J. A., & De Jong, M. C. M. (2014). Transmission of
fish-borne zoonotic trematodes (Heterophyidae) to common carp (Cyprinus carpio) is
independent of density of fish and trematodes. Journal of Helminthology, 88, 183–188.
https://doi.org/10.1017/S0022149X12000910
Bray, R. A., Gibson, D. I., & Jones, A. (Eds.) (2008): Keys to the Trematoda Vol. 3. CAB
International and Natural History Museum.
Cantu, V., Brandt, T. M., & Arsuffi, T. L. (2013). An evaluation of three sampling methods to
monitor a digenetic trematode Centrocestus formosanus in a spring-fed ecosystem.
Parasitology, 140, 814-820. https://doi.org/10.1017/S0031182013000085
Chai, J. Y., De, N. V., & Sohn, W. M. (2012). Foodborne trematode metacercariae in fish from
Northern Vietnam and their adults recovered from experimental hamsters. Korean Journal
of Parasitology, 50, 317-325. https//doi: 10.3347/kjp.2012.50.4.317
Chai, J. Y., Sohn, W. M., Yong, T. S., Eom, K. S., Min, D. Y., Lee, M. Y., Lim, H., Insisiengmay,
B., Phommasack, B., & Rim, H. J. (2013). Centrocestus formosanus (Heterophyidae):
human infections and the infection source in Lao PDR. Journal of Parasitology, 99,
531-536. https://doi.org/10.1645/12-37.1
Gjurcevic, E., Petrinec, Z., Kozaric, Z., Kuzir, S., Kantura, V. G., Vucemilo, M., & Dzaja, P. (2007).
Metacercariae of Centrocestus formosanus in goldfish (Carassius auratus L.) imported into
Croatia. Helminthologia, 44, 214-216. https://doi.org/10.2478/s11687-007-0034-4
Han, E. T., Shin E. H., Phommakorn S., Sengvilaykham B., Kim J. L., Rim, H. J., & Chai, J. Y.
(2008). Centrocestus formosanus (Digenea: Heterophyidae) encysted in the freshwater
fish, Puntius brevis, from Lao PDR. Korean Journal of Parasitology, 46 (1), 49–53.
https//doi.org/10.3347/kjp.2008.46.1.49
Hernández, L. E., Díaz, M. T., & Bashirullah, A. D. (2003). Description of different developmental
stages of Centrocestus formosanus (Nishigori, 1924) (Digenea: Heterophyidae). Revista
Científica, FCV-LUZ, XIII (4):285-292.
Hop, N. T., De, N.V., Murrell, D., & Dalsgaard, A. (2007). Occurrence and species distribution of
fish borne zoonotic trematodes in wastewater-fed aquaculture in northern Vietnam. Tropical
Medicine & International Health, 12, 66-72. https://doi.org/10.1111/j.1365-3156.2007.01943.x
Knoff, M., Pinto, R. M., Clemente S. C. D., Fonseca, M. C. G., & Gomes, D. C. (2011).
Diphyllobothrium latum and Diphyllobothrium sp. as the agents of Diphyllobothriasis in
Brazil: morphological analysis and of two new case reports. Revista Brasileira de Medicina
Veterinária, 33, 159-164.
Li, M. H., Huang, H. I., Chen, P. L., Huang, C. H., Chen, Y. H., & Ooi, H. K. (2013). Metagonimus
yokogawai: metacercariae survey in fishes and its development to adult worms in various
rodents. Parasitology Research, 112, 1647-1653. https://doi.org/10.1007/s00436-013-3320-8
Mati, V. L. T, Pinto, H. A., & de Melo, A. L. (2013). Experimental infections of Swiss and AKR/J
mice with Centrocestus formosanus (Trematoda: Heterophyidae). Revista do Instituto de
Medicina Tropical de São Paulo, 55, 133-136. https://doi.org/10.1590/S0036-46652013000200013
Mitchell, A. J., Goodwin, A. E., Salmon, M. J., & Brandt, T. M. (2002). Experimental infection
of an exotic heterophyid trematode, Centrocestus formosanus, in four aquaculture fishes.
North American Journal of Aquaculture, 64, 55-59. https://doi10.1577/1548-8454
(2002)064<0055:EIOAEH>2.0.CO;2
Mitchell, A. J., Overstreet, R. M., Goodwin, A. E., & Brandt, T. M. (2005). Spread of an exotic
fish-gill trematode: A far-reaching and complex problem. Fisheries, 30, 11-16.
Mitchell, A. J., Salmon, M. J., Huffman, D. G., Goodwin, A. E., & Brandt, T. M. (2000). Prevalence
and pathogenicity of a heterophyid trematode infecting the gills of an endangered fish, the
fountain darter, in two central Texas spring-fed rivers. Journal of Aquatic Animal Health, 12,
283-289. http://dx.doi.org/10.1577/1548-8667(2000)012%3C0283: PAPOAH% 3E2.0.CO;2
Nguyen, V. D., & Thanh, H. L. (2011). Human infections of fish-borne trematodes in Vietnam:
Prevalence and molecular specific identification at an endemic commune in Nam Dinh
province. Experimental Parasitology, 129, 355-361. https://doi.org/10.1016/j.exppara.2011.09.005
Paperna, I., & Dzikowski, R. (2006). Digenea (Phylum Platyhelminthes). En: P.T.K. Woo (Ed.)
Fish Diseases and Disorders, Protozoan and Metazoan Infections Vol. 1. (pp. 355-390.).
CAB International.
Pérez-Ponce de León, G., García-Prieto, L., & Mendoza-Garfias, B. (2007). Trematode parasites
(Platyhelminthes) of wildlife vertebrates in Mexico. Zootaxa, 1534, 1-247. https://doi
org/10.11646/zootaxa.1534.1.1
Pinto, H. A., & de Melo, A. L. (2010) Melanoides tuberculata (Mollusca:Thiaridae) as an intermediat host of
Centrocestus formosanus (Trematoda: Heterophyidae) in Brazil. Revista do Instituto de Medicina
Tropical de São Paulo, 52, 207-210. https://doi.org/10.1590/S0036-46652010000400008
Pinto, H .A., Mati, V. L. T., & de Melo, A. L. (2015). Experimental centrocestiasis: Worm burden,
morphology and fecundity of Centrocestus formosanus (Trematoda: Heterophyidae) in
dexamethasone immunosuppressed mice. Parasitology International, 64, 236-239.
https://doi.org/10.1016/j.parint.2015.02.002
Pinto, H. A., Gonçalves, N. Q., López-Hernandez, D., Pulido-Murillo, E. A., & de Melo, A. L.
(2018). The life cycle of a zoonotic parasite reassessed: Experimental infection of Melanoides
tuberculata (Mollusca: Thiaridae) with Centrocestus formosanus (Trematoda: Heterophyidae).
PloS one, 13(4), e0194161. https://doi.org/10.1371/journal.pone.0194161
Pritchard, M. H., & Kruse, G. O. W. (1982). The Collection and Preservation of Animal Parasites.
University of Nebraska Press.
Rábago-Castro, J. L., Sánchez-Martínez, J. G., Loredo-Osti, J., Gómez-Flores, R., Tamez-Guerra,
P., & Ramírez-Pfeiffer, C. (2011). Temporal and spatial variations of ectoparasites on
cage-reared channel catfish, Ictalurus punctatus, in Tamaulipas, Mexico. Journal of the
World Aquaculture Society, 42, 406-411. http://dx.doi.org/10.1111/j.1749-7345. 2011.00480.x
Rosas-Valdez, R., & Pérez-Ponce de León, G. 2008. (2008). Composición taxonómica de los
helmintos parásitos de ictalúridos y heptaptéridos (Osteichthyes: Siluriformes) de México,
con una hipótesis de homología biogeográfica primaria. Revista Mexicana de Biodiversidad,
79, 473-499.
Schell S. C. (1970). The Trematodes. W. M. C. Brown Company Publishers.
Scholz, T., & Salgado-Maldonado, G. (2000). The introduction and dispersal of Centrocestus
formosanus (Nishigori, 1924) (Digenea: Heterophyidae) in Mexico: A review. American
Midland Naturalist, 143, 185-200. http://dx.doi.org/10.1674/0003-0031(2000)143%5b0185:
TIADOC% 5d2.0.CO;2
Velásquez, L. E., Bedoya, J. C., Areiza, A., & Vélez, I. (2006). Primer registro de Centrocestus
formosanus (Digenea: Heterophyidae) en Colombia. Revista Mexicana de Biodiversidad,
77, 119-121.
Yousif, F., Ayoub, M., Tadros, M., & El Bardicy, S. (2016). The first record of Centrocestus
formosanus (Nishigori, 1924) (Digenea: Heterophyidae) in Egypt. Experimental Parasitology,
168, 56-654. https://doi.org/10.1016/j.exppara.2016.06.007