Criptococosis mucocutánea del plano nasal en un perro: reporte de caso
Mucocutaneous cryptococcosis of nasal planum in a dog: a case report
Luis Mario Leyva-Zapata, José Luis Palomares-Rangel, Ana Cecilia Guevara-Mata,
Elva Karina Calvillo-Huereca, Verónica Carvajal-de la Fuente*
Autor para correspondencia: vcarvajal@docentes.uat.edu.mx Fecha de recepción: 29 de junio de 2023
Fecha de aceptación: 13 de julio de 2023 Fecha de publicación: 11 de agosto de 2023
Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Tamaulipas. Ciudad Victoria, Tamaulipas, México.
![]()
ISSN electrónico: 2992-7501 1(1), 1 - 12 (Jul - Dic 2023)
https://doi.org/10.29059/cvpa.v2i2.12
Resumen
Se presenta caso de paciente canino mestizo macho de 5 años con historia de deformidad facial por abultamiento en plano nasal con diagnóstico presuntivo de neoplasia intranasal. Se solicitó biopsia incisional para estudio histopatológico que reveló dermatitis piogranulomatosa severa zonalmente extensiva con presencia de estructuras levaduriformes encapsuladas compatibles con Cryptococcus sp. Se realizó cultivo micológico donde se aisló Cryptococcus sp. La terapia con fluconazol por 65 días resultó efectiva con resolución de signos clínicos. El paciente ha permanecido asintomático durante más de un año después de haber finalizado la terapia. De acuerdo con la literatura revisada, este es el primer caso de criptococosis reportado en un perro del estado de Tamaulipas, México.
Palabras clave: criptococosis, plano nasal, perro, diagnóstico, pronóstico.
Abstract
A 5-year-old male mongrel dog was presented for a history of facial deformity due to nasal plane bulging with a presumptive diagnosis of intranasal neoplasia. An incisional biopsy of the lesion was performed. Histopathology findings showed a severe zonally extensive pyogranulomatous dermatitis with many yeast-like encapsulated organisms, compatible with Cryptococcus sp. Mycological culture was performed where Cryptococcus sp. was isolated. After 65 days of fluconazole treatment showed complete disappearance of the nasal lesions. The patient has remained asymptomatic for more than a year after the completion of therapy. According to the literature reviewed, this is the first reported case of cryptococcosis in a dog from Tamaulipas State, Mexico.
Keywords: cryptococcosis, nasal planum, dog, diagnosis, prognosis.
Introducción
La criptococosis es una de las infecciones fúngicas sistémicas de mayor relevancia que afecta a una amplia gama de especies animales incluyendo perros, gatos y humanos (Rajasingham et al., 2017). La enfermedad es producida por el hongo levaduriforme Cryptococcus neoformans, sin embargo, Cryptococcus gattii se ha aislado, aunque con menor frecuencia (McVey et al., 2022). La criptococosis se ha reportado a nivel mundial como una de las principales causas de muerte asociadas al Virus de la Inmunodeficiencia Humana (VIH) con un millón de personas afectadas anualmente (Soares et al., 2019). En México, desde hace casi una década, se ha estimado que en el 10% de las personas con meningoencefalitis, se ha aislado este hongo, y el 28% de estos casos, están infectados con el virus VIH (López-Martínez et al., 2014).
Existe escasa información sobre estudios epidemiológicos de Criptococosis en animales en nuestro país. Este hongo saprófito oportunista se puede encontrar con frecuencia en lugares donde hay heces de palomas y materia orgánica en degradación ya que se ha demostrado que las altas concentraciones de urea, creatinina y otros compuestos nitrogenados que contiene las excretas de éstas y otras aves, propician un ambiente idóneo para el crecimiento de la levadura (Coelho & Farrer, 2020; Rosario et al., 2008).
En las últimas décadas, los casos de criptococosis en medicina humana y veterinaria se han incrementado considerablemente sobre todo en aquellos individuos inmunocomprometidos, que sufren alguna condición debilitante o los que se encuentran bajo tratamientos con terapias de esteroides por largos periodos de tiempo (Rajasingham et al., 2017).
La infección inicia como una enfermedad respiratoria crónica debido a su vía de entrada aérea, y posteriormente se disemina hacia la piel y órganos internos con especial tropismo hacia el sistema nervioso central donde se desarrollarán nódulos granulomatosos (Maxie, 2015; McVey et al., 2022; Zachary, 2017).
El diagnóstico de la enfermedad se realiza mediante la observación microscópica directa de las levaduras en muestras citológicas e histopatológicas teñidas con Hematoxilina y Eosina (H&E). No obstante, estas técnicas tienen limitantes ya que en ocasiones la cápsula de las levaduras es difícil de observar debido a que es altamente hidrofílica llegándose a confundir fácilmente con otro tipo de levaduras.
El Ácido Peryódico de Schiff (PAS, por sus siglas en inglés), Grocott y Mucicarmín de Mayer se usan como tinciones alternativas para observar con mejor claridad a este patógeno (Zachary, 2017). El cultivo y aislamiento de la levadura se considera como el método de diagnóstico microbiológico de referencia (sensibilidad de 90%) en el cual se realiza a partir de distintos fluidos, secreciones o tejidos afectados (Arias & Montero, 2011).
El agar Sabouraud sin cicloheximida es el medio más utilizado en donde después de incubarse 48-72 h crecerá la levadura formando colonias mucosas de color blanco cremosa (Castellá et al., 2008). Para el tratamiento de la criptococosis se emplean azoles, como el fluconazol y el itraconazol (McVey et al., 2022; O’Brien et al., 2006).
Descripción del caso clínico
En una clínica veterinaria particular del Municipio de Río Bravo, Tamaulipas, se llevó a consulta, un canino macho de raza mestiza de 5 años que mostraba deformidad facial debido al abultamiento localizado en el plano nasal con evolución de aproximadamente dos años. El diagnóstico clínico presuntivo realizado por un veterinario fue una neoplasia nasal. El perro vivía dentro de casa y no tenía antecedentes de haber viajado fuera de la región geográfica antes mencionada. Al examen físico general, el paciente estaba alerta y responsivo sin presencia de fiebre (temperatura corporal de 37.5 °C) y condición corporal de 3/5. Presentaba estornudos y descarga mucopurulenta que provenía de ambas fosas nasales. Además del abultamiento en el plano nasal, se pudo observar descamación en la trufa con lesiones costrosas y ulceradas profundas (Figura 1). Como plan diagnóstico inicial se colectaron muestras sanguíneas para hemograma y bioquímica sanguínea, junto con tres muestras de biopsias incisionales de la piel del plano nasal de aproximadamente 0.6 cm de diámetro las cuales fueron fijadas con formol buferado al 10% durante 24 h. Posteriormente, se realizaron cortes histológicos de 5 μm de grosor y fueron teñidos con H&E.
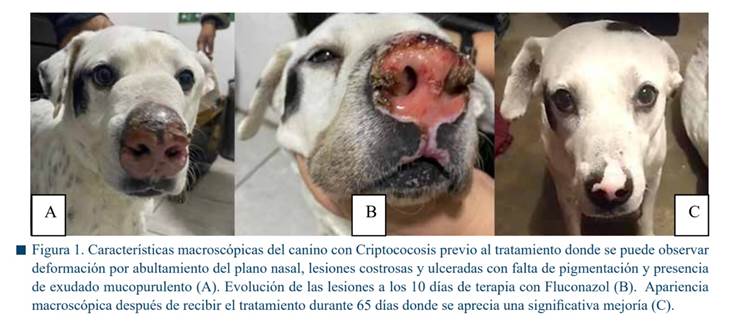
Resultados
Hemograma y química sanguínea
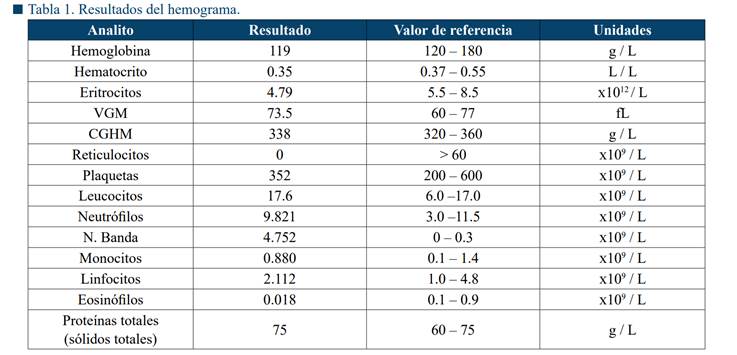
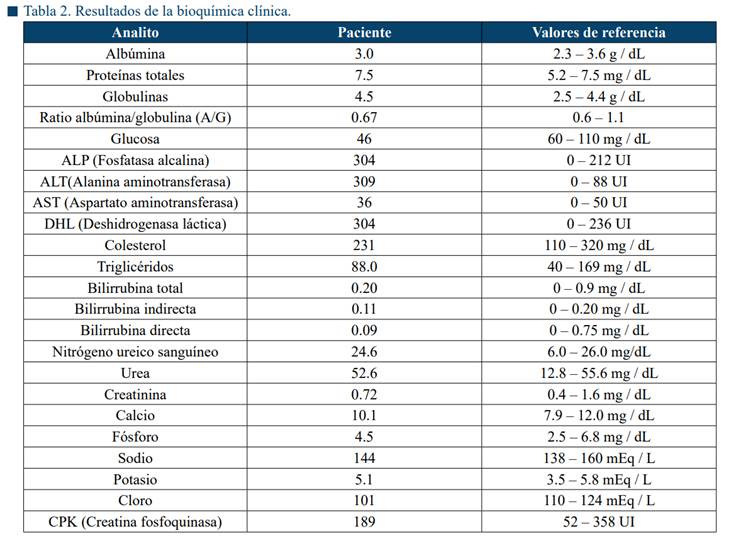
Los resultados del hemograma revelaron una anemia leve normocítica normocrómica no regenerativa y ligera leucocitosis con moderada desviación a la izquierda compatible con un proceso inflamatorio (Tabla 1). En la bioquímica sanguínea se encontró hipoglucemia, hiperglobulinemia leve, así como un ligero incremento de las enzimas hepatobiliares ALP, ALT y DHL (Tabla 2).
Histopatología
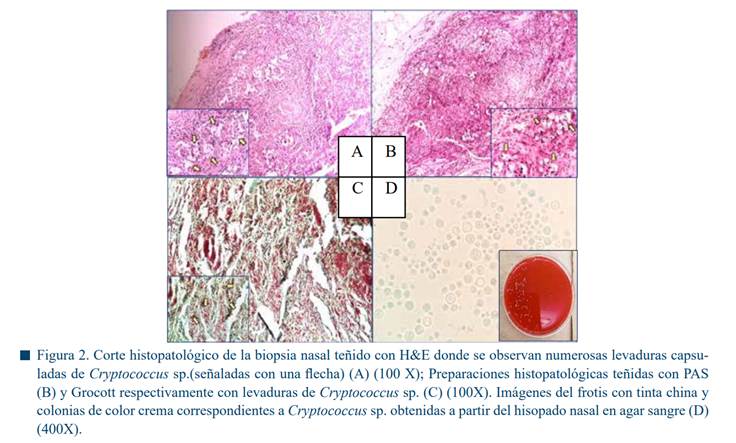
El estudio histopatológico reveló una dermatitis piogranulomatosa severa zonalmente extensiva con la presencia de abundantes estructuras levaduriformes intralesionales de formas redondeadas, con presencia de un halo transparente a su alrededor de 15 a 20 micrómetros de diámetro compatibles con Cryptococcus sp. (Figura 2A). En base a estos resultados se realizaron tinciones complementarias para evidenciar mejor la presencia de estructuras micóticas.
Las levaduras intralesionales resultaron positivas a la tinción de PAS (Figura 2B) y Grocott (Figura 2C). Además, se utilizó la tinción de tinta china (tinción negativa) cuyo objetivo es teñir la preparación excepto la cápsula de la levadura (Figura 2C).
Cultivo
Para establecer el diagnóstico definitivo del agente etiológico, se realizó cultivo micológico a partir de muestras de hisopados del exudado nasal. Para este fin se utilizaron tres medios de cultivo, los cuales fueron: agar sangre, dextrosa papa y agar Sabouraud. El cultivo fue incubado a una temperatura de 30 ºC durante 72 h, después de este tiempo aparecieron colonias redondas, convexas, con bordes lisos, de color café o crema brillante sugerente de un agente levaduriforme (Figura 2D). Después del crecimiento de la colonia, se tomó una sección de ella para la caracterización morfológica del agente con tinta china, en la cual se observaron las estructuras compatibles con Cryptococcus sp. (Figura 2C) (McVey et al., 2022).
Tratamiento
En base al diagnóstico se inició terapia antifúngica oral con fluconazol a 5 mg/kg BID (Bis in Die por sus siglas en inglés o dos veces al día) por 65 días sin presentar complicaciones secundarias al medicamento o al cuadro infeccioso. El paciente permaneció asintomático durante más de un año después de haber finalizado la terapia.
Discusión
La criptococosis ha sido reportada en una gran variedad de animales domésticos y en contraste con otras micosis profundas, es más frecuente observarla en el gato que en el perro (Castellá et al., 2008). La vía de infección más frecuente es la aérea, afectando inicialmente las vías respiratorias altas. Aproximadamente un 80% de los gatos afectados manifestarán rinitis granulomatosa con deformación de la cavidad nasal (Coelho et al., 2020).
A diferencia de las alteraciones nasales observadas en felinos, se ha reportado que los perros rara vez presentan esta signología (Castellá et al., 2008; Pérez et al., 2015). En este caso en particular, el paciente presentó lesiones similares a las descritas en gatos, como deformidad del plano nasal con secreción mucopurulenta y dermatitis piogranulomatosa severa crónica (Candanosa et al., 2015). Sin embargo, a pesar de que cursó por un cuadro crónico, resultó tener un pronóstico favorable debido a que la patología fue limitada y tuvo una excelente repuesta al tratamiento con fluconazol. Por otro lado, Bowles y Fry en el 2009, reportan el caso de un canino hembra Pointer Alemán que presentó tumoración del lado izquierdo del rostro con presentación clínica aguda, seguida de signos respiratorios severos, y al instaurar el tratamiento con fluconazol, presentó aún mayor deformidad nasal con compromiso del sistema nervioso central.
En contraste, De Iturriaga y Espejo en 1996, describe el caso de un Cocker Spaniel macho de 6 años, que presentó estornudos y secreción nasal mucopurulenta durante 3 años sin respuesta a antibióticos, y subsecuentemente desarrolló tumoración subcutánea sobre el puente de la nariz, después de confirmar el diagnóstico por histopatología de criptococosis, fue tratado durante dos meses con ketoconazol con una evolución satisfactoria.
Se ha reportado que los animales con criptococosis crónica y aquellos que presentan lesiones en sistema nervioso central o en varios órganos, suelen tener un pobre desenlace (Vorathavorn et al., 2013).
Por otro lado, otras investigaciones han demostrado que dichas lesiones no determinan el pronóstico de los pacientes (Pérez et al., 2015). Se dice que para la resolución completa de la criptococosis no basta con la desaparición de los signos, sino que es importante también comprobar la ausencia de títulos contra el hongo en líquido cefalorraquídeo (LCR) para disminuir la posibilidad de reincidencia, la cual puede ocurrir en meses o años (Vorathavorn et al., 2013).
Los hallazgos de laboratorio frecuentemente observados en un hemograma de un perro con criptococosis es una anemia normocítica normocrómica de tipo no regenerativa, además, en la serie blanca suelen asociarse con una respuesta inflamación crónica (Stockham & Scott, 2008). Los cambios anteriormente descritos coinciden con los reportados en este paciente. No obstante, estas alteraciones no son específicas de criptococosis ya que éstas pueden observarse en cualquier enfermedad inflamatoria con un curso crónico dificultando su diagnóstico (Stockham & Scott, 2008). Otro cambio observado en la sangre de este canino fue un incremento de las inmunoglobulinas, el cual, en ausencia de deshidratación, se asoció a un proceso inflamatorio.
Asimismo, se encontró un ligero incremento de las enzimas alanina aminotransferasa (ALT), deshidrogenasa láctica (DHL) y fosfatasa alcalina (FA) sugiriendo un daño hepatobiliar; sin embargo, no se realizaron estudios adicionales para descartar la presencia de alguna lesión en este órgano.
El género Cryptococcus incluye alrededor de 100 especies, pero sólo Cryptococcus neoformans (95% de los casos) y Cryptococcus gattii son de importancia clínica para el humano y el perro (Maziarz & Perfect, 2016). El interés de identificar hasta el nivel de especie se basa en el hecho de que C. gattii provoca infecciones más agresivas que requieren un enfoque terapéutico mucho más intensivo que las que son provocadas por C. neoformans (Chen et al., 2014). Las técnicas convencionales para la detección de Cryptococcus sp. son la histopatología donde utilizan distintas tinciones especiales (PAS, Grocott y Tinta China) que permiten visualizar con mayor facilidad las levaduras como en este caso (Figura 2).
Además, el diagnóstico definitivo se consigue mediante el cultivo y aislamiento de las levaduras donde se observan, después de incubarse, colonias lisas de textura mucoide y coloración blanco cremosa como las reportadas en este trabajo. Sin embargo, estas técnicas no permiten diferenciar la especie de Cryptococcus involucrado ya que, para tal fin, se requieren estudios bioquímicos adicionales como pruebas de asimilación y utilización de ciertos carbohidratos, así como, pruebas de asimilación de creatinina y producción de ureasa entre otras (Maziarz & Perfect, 2016).
Por lo anterior, en casos posteriores, se recomienda utilizar estas pruebas más específicas con el fin de obtener una precisa identificación del hongo. La importancia del diagnóstico de la criptococosis reside en la identificación temprana de los focos de infección a los que están expuestos aquellos individuos susceptibles con el fin de tomar las medidas adecuadas para evitar su diseminación y de esta manera salvaguardar la salud de los animales y por ende la del ser humano.
Conclusiones
Este caso evidencia que la criptococosis en perros puede afectar principalmente a la cavidad nasal y puede llegar a confundirse fácilmente con otras patologías que cursen con tumefacción como en el caso de neoplasias. Se recomienda utilizar pruebas más específicas para poder conocer la especie de Cryptococcus involucrada en casos clínicos futuros.
El diagnóstico temprano permitirá instaurar un tratamiento oportuno y tener, como en este caso, un mejor pronóstico. Si bien, el riesgo de desarrollar esta infección micótica es bajo, el reporte de este caso en un perro en el estado de Tamaulipas debe alertar a los veterinarios en cuanto a la necesidad de considerarla en la lista de diagnósticos diferenciales en pacientes con signología similar a la descrita en este documento.
Referencias
Arias, B. G., & Montero, L. M. (2011). Criptococosis meníngea: características clínicas y de laboratorio. Acta Neurológica Colombiana, 27(1), 19-27. http://www.scielo.org.co/scielo. php?script=sci_arttext&pid=S0120-87482011000100004
Bowles, D. B., & Fry, D. R. (2009). Nasal cryptococcosis in two dogs in New Zealand. New Zealand Veterinary Journal, 57(1), 53-57. https://doi.org/10.1080/00480169.2009.36869
Candanosa, I., García, L, Juárez, M., Martínez, I., Méndez, A., & Morales, E. (2015). Patología Sistémica Veterinaria. 6ta ed. Trigo F, Romero L, editores. Ciudad de México.
Castellá, G., Abarca, M. L., & Cabañes, F. J. (2008). Criptococosis y animales de compañía. Revista Iberoamericana de Micología, 25(1), S19-S24. https://doi.org/10.1016/s1130- 1406(08)70021-4
Chen, S. C., Meyer, W., & Sorrell, T. C. (2014). Cryptococcus gattii Infections. Clinical Microbio- logy Reviews, 27(4), 980-1024. https://doi.org/10.1128/cmr.00126-13
Coelho, C., & Farrer, R. A. (2020). Pathogen and host genetics underpinning cryptococcal disease. En Elsevier eBooks (pp. 1-66). https://doi.org/10.1016/bs.adgen.2020.02.001
De Iturriaga, I. G., & Espejo, M. A. O. (1996). Criptococosis canina: descripción de un caso clínico. Clínica veterinaria de pequeños animales: revista oficial de AVEPA, Asociación Veterinaria Española de Especialistas en Pequeños Animales, 16(4), 235-243. https://dialnet.unirioja. es/servlet/articulo?codigo=6723557
López-Martínez, R., Córdova-Martínez, E., Bazán-Mora, E., Mondragón-Ordóñez, M.,
Angeles-Morales, V., García-Zaldívar, P., & Castañón-Olivares, L. R. (2014). Frecuencia de serotipos de Cryptococcus neoformans/C. gattii en México. Revista Latinoamericana de Patología Clínica y Medicina de Laboratorio, 61(2), 125-128. https://www.medigraphic. com/pdfs/patol/pt-2014/pt142h.pdf
Maxie, G. (2015). Jubb, Kennedy & Palmer’s Pathology of Domestic Animals - E-Book: Elsevier Health Sciences.
Maziarz, E. K., & Perfect, J. R. (2016). Cryptococcosis. Infectious Disease Clinics of North
America, 30(1), 179-206. https://doi.org/10.1016/j.idc.2015.10.006
McVey, D. S., Kennedy, M., Chengappa, M. M., & Wilkes, R. (2022). Veterinary Microbiology. John Wiley & Sons.
O’Brien, C., Krockenberger, M. B., Martin, P. G., Wigney, D. I., & Malik, R. (2006). Long-term outcome of therapy for 59 cats and 11 dogs with cryptococcosis. Australian Veterinary
Journal, 84(11), 384-392. https://doi.org/10.1111/j.1751-0813.2006.00040.x
Pérez, F. P., Avila, O., Vélez, N., & Escandón, P. (2015). Cryptococcosis in Dogs: A Case Report in a Labrador retriever in Bogotá, Colombia. Medical Mycology: Open Access, 1(1).
https:// doi.org/10.21767/2471-8521.100004
Rajasingham, R., Smith, R. A., Park, B. J., Jarvis, J. N., Govender, N. P., Chiller, T., Denning, D.
W., Loyse, A., & Boulware, D. R. (2017). Global burden of disease of HIV-associated cryp-
tococcal meningitis: an updated analysis. Lancet Infectious Diseases, 17(8), 873-881.
https://doi.org/10.1016/s1473-3099(17)30243-8
Rosario, I., Acosta, B., & Colom, M. F. (2008). La paloma y otras aves como reservorio de
Cryptococcus spp. Revista Iberoamericana de Micologia, 25(1), S13-S18. https://doi.
org/10.1016/s1130-1406(08)70020-2
Soares, E. A., Lazéra, M. D. S., Wanke, B., De Faria Ferreira, M., De Oliveira, R. A., Oliveira, A. G., & Coutinho, Z. F. (2019). Mortality by cryptococcosis in Brazil from 2000 to 2012: A descriptive epidemiological study. PLOS Neglected Tropical Diseases, 13(7), e0007569. https://doi.org/10.1371/journal.pntd.0007569
Stockham, S. L., & Scott, M. A. (2008). Fundamentals of Veterinary Clinical Pathology.
Wiley-Blackwell.
Vorathavorn, V. I., Sykes, J. E., & Feldman, D. (2013). Cryptococcosis as an emerging
systemicmycosis in dogs. Journal of Veterinary Emergency and Critical Care, n/a. https:// doi.org/10.1111/vec.12087
Zachary, J. F. (2017). Pathologic basis of veterinary disease. 6th ed. St Louis. Elsevier.